Estatus epiléptico en la infancia
- Status Epiléptico neonatal.
El periodo neonatal es el momento de la vida con mayor riesgo de aparición de crisis epilépticas, con una incidencia de 1 a 3,5 casos por cada 1000 recién nacidos vivos. (Alcover-Bloch et al; 2004, Lawrence et al; 2010, Navarro-Carmona et al; 2008).
El riesgo relativo de crisis es mayor en recién nacidos pretérmino por debajo de 30 semanas de edad gestacional con respecto a recién nacidos a término (Jensen; 2009, Lawrence et al; 2010, Glass et al; 2009a).
-Definición del status epiléptico neonatal.
Las crisis en el periodo neonatal suponen la forma más frecuente de presentación de lesión cerebral y pueden aparecer como crisis aisladas, como crisis recurrentes o como status epiléptico (SE), este último habitualmente en relación con lesiones más severas (Lawrence et al; 2010, Jensen; 2009).
El SE neonatal es a veces difícil de identificar puesto que con frecuencia cursa con manifestaciones sutiles difíciles de reconocer clínicamente y no suele existir en el EEG actividad epileptiforme generalizada sino actividad multifocal migratoria (Lawrence et al; 2010).
Además, es difícil establecer una definición de SE en el periodo neonatal, ya que no existe consenso sobre el tiempo a partir del cual existe daño neuronal; es decir, el tiempo a partir del cual las crisis son relevantes para el cerebro en desarrollo (Glass et al; 2009a, Lawrence et al; 2010, Jensen; 2009).
Algunos estudios proponen definir el SE neonatal por la presencia de actividad epileptiforme en más del 50% del registro EEG, con una evidente controversia respecto a cuánto tiempo debe durar el referido registro EEG (Lawrence et al; 2010).
-Fisiopatología del SE neonatal.
Durante el periodo neonatal se presentan mecanismos específicos que influyen sobre el desarrollo de crisis epilépticas, la forma de presentación de las crisis, su impacto sobre la función y estructura cerebral, y la eficacia global de los fármacos antiepilépticos en el tratamiento agudo (Glass et al; 2009a, Jensen; 2009).
Existe por una parte una hiperexcitabilidad neuronal relativa que provoca una incidencia mayor de crisis en este periodo respecto a etapas posteriores de la vida. Además, el desarrollo incompleto de los neurotransmisores se traduce en una falta de dianas terapéuticas para los antiepilépticos convencionales, con peor respuesta global a ellos y, por último, la menor mielinización cortico-subcortical es responsable de la naturaleza multifocal y la semiología específica de las crisis en esta etapa (Glass et al; 2009a, Jensen; 2009).
Existe una sobreexpresión de receptores de glutamato tipo NMDA y AMPA tanto en las regiones sinápticas como extrasinápticas de las neuronas y de la glía (Jensen; 2009) y la expresión de receptores GABA está disminuida, y además su composición es especial, con mayor expresión de subunidad α4, la cual induce menor sensibilidad del receptor a las benzodiacepinas. Además, en el cerebro inmaduro, la activación de receptores GABA puede inducir despolarización en lugar de hiperpolarización y por tanto generar una hiperexcitabilidad neuronal (Jensen; 2009).
DIAGNÓSTICO DEL SE NEONATAL.
El diagnóstico del SE es eminentemente electro-clínico, necesitando definir correctamente la semiología de los episodios paroxísticos y realizando un adecuado correlato de los mismos con el registro EEG o vídeo-EEG, con el fin de diferenciar las auténticas crisis de los TPNE, principalmente en el grupo de los grandes prematuros (Lawrence et al; 2010)
-Diagnóstico de crisis.
Es fundamental conocer la semiología clínica de los episodios paroxísticos que pueden ser etiquetados como auténticas crisis neonatales y poder constituir así un auténtico SE neonatal.
Semiología de las crisis (Fenichel; 2010, Lawrence et al; 2010, Alcover-Bloch et al; 2004, Navarro-Carmona et al; 2008). Consultar: http://www.neuropedwikia.es/content/clasificacion-de-las-crisis-neonatal...
La correlación clínico-EEG de las crisis epilépticas en el periodo neonatal es pobre (Fenichel; 2010, Navarro-Carmona et al; 2008, Lawrence et al; 2010). En el 80-90% de los casos en que se detecta actividad epileptiforme en el EEG, incluyendo SE, no se identifican manifestaciones clínicas y por otra parte, en un 30-40% de las crisis diagnosticadas clínicamente no existe actividad epileptiforme bien definida en el EEG (Lawrence et al; 2010, Silverstein et al; 2007, Vento et al; 2010). Por tanto, el diagnóstico de crisis en periodo neonatal no debe ser exclusivamente clínico y debe apoyarse en el registro EEG. El “gold standard” en cuanto a detección de crisis epilépticas es el EEG convencional (cEEG). Sin embargo, debido a su escasa disponibilidad, en las unidades de cuidados intensivos neonatales está aumentando el uso del EEG integrado por amplitud (aEEG), que se obtiene mediante un monitor de función cerebral. Las ventajas del aEEG son su disponibilidad inmediata y su fácil interpretación, mientras que su principal limitación es su escasa sensibilidad, con cifras muy variables, entre el 12 y el 80%. (Lawrence et al; 2010, Navarro-Carmona et al; 2008, Glass et al; 2009a).http://www.neuropedwikia.es/content/diagnostico-de-las-crisis-neonatales.
PRONÓSTICO DEL SE NEONATAL.
El SE neonatal es una emergencia que requiere tratamiento inmediato para evitar la muerte neuronal que se produce por la descarga excesiva o la hiperexcitabilidad neuronal sobre un cerebro en desarrollo.
-Morbi-mortalidad del SE neonatal.
Existen pocos datos sobre la morbi-mortalidad del SE neonatal. Se ha descrito una mortalidad del 25-40%, en descenso actualmente gracias a las mejoras en los cuidados neonatales, y un riesgo de secuelas neurológicas evolutivas del 30-70%, del tipo de parálisis cerebral infantil, trastornos del aprendizaje, retraso mental o epilepsia en etapas posteriores (Silverstein et al; 2007, Jensen; 2009, Pisani et al; 2007, Glass et al; 2009a, Glass et al; 2009b, Lawrence et al; 2010).
Es difícil distinguir si las secuelas se deben al daño producido por la crisis epiléptica en sí o a la lesión que causa la crisis epiléptica (Pisani et al; 2007). Por una parte, algunos estudios observan una clara relación entre la etiología subyacente y el pronóstico, que será peor en caso de crisis neonatales secundarias a encefalopatía hipóxico-isquémica, hemorragia intracraneal o malformaciones del desarrollo cortical, y peor cuanto mayor sea el daño cerebral por estas causas (Jensen; 2009, Glass et al; 2009a). Sin embargo, otros estudios apuntan a la existencia de una relación directa entre la severidad de las crisis (entendida por su duración y frecuencia) y la gravedad de las secuelas neurológicas, sin influencia definida del grado de severidad de la lesión subyacente ni de su etiología (Lawrence et al; 2010, Blume et al; 2009, Glass et al; 2009b).
Sin embargo, parece que el cerebro inmaduro es más resistente al daño inducido por crisis o SE. De esta forma, se observa mayor riesgo de daño neurológico tras SE en neonatos a término que en prematuros, aunque esto también puede deberse a la mayor incidencia de encefalopatía hipóxico-isquémica como causa del SE en el primer grupo (Pisani et al; 2007).
TRATAMIENTO DEL SE NEONATAL.
El tratamiento del SE neonatal se debe dirigir a detener la actividad convulsiva, corregir las etiologías potencialmente tratables, mantener la homeostasis y el medio interno, anticiparse al desarrollo de complicaciones sistémicas y neurológicas y garantizar, siempre que sea factible, una adecuada neuroprotección (Lawrence et al; 2010)
El tratamiento etiológico específico se realizará siempre que se identifique una causa tratable como infección primaria del SNC, hipoglucemia, hipocalcemia, hipomagnesemia, dependencia de piridoxina o piridoxal fosfato, etc. (Lawrence et al; 2010, Navarro-Carmona et al; 2008, Fenichel; 2010).
Las crisis en periodo neonatal son con frecuencia refractarias a fármacos antiepilépticos útiles en otras edades, debido a que están mediadas por mecanismos especiales, propios de un cerebro inmaduro con aumento de la expresión de receptores para neurotransmisores excitatorios como glutamato, y disminución de la expresión de receptores para neurotransmisores potencialmente inhibitorios como GABA (Jensen; 2009, Lawrence et al; 2010, Glass et al; 2009a).
-Medidas de acción farmacológica en el SE neonatal.
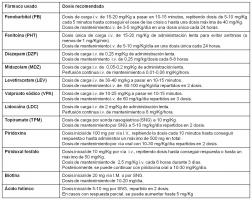
Durante muchos años, el fenobarbital (PB) ha mantenido una total hegemonía en este aspecto, aunque últimamente algunos otros fármacos como las benzodiacepinas (BZD), fenitoína (PHT), valproato (VPA) y levetiracetam (LEV) se han ido incorporando lentamente al arsenal terapéutico neonatal. Las dosis de los diversos fármacos usados en el SE neonatal se pueden consultar en [fármacos usados en el SE neonatal.jpg].
Es importante realizar una actuación terapéutica bien sistematizada, conociendo bien cuál es el valor real y las dosis de cada uno de los FAE (ver “algoritmo estatus neonatal.jpg”).
Fenobarbital (PB) (Campistol; 2000, Blume et al; 2009, Glass et al; 2009a, Castro-Conde et al; 2005, Lawrence et al; 2010, Navarro-Carmona et al; 2008, Fenichel; 2010, Vento et al; 2010, Forcelli et al; 2010, Blanco et al; 2011, Barks et al; 2010).
Sigue siendo el fármaco más utilizado, a pesar de que existe consenso sobre su escasa eficacia global, consiguiendo controlar menos del 50% de las crisis (Blume et al; 2009, Glass et al; 2009a, Castro-Conde et al; 2005).
Algunos estudios reflejan un potencial riesgo del PB como inductor de apoptosis neuronal en animales y de deterioro neurocognitivo en humanos (Vento et al; 2010, Forcelli et al; 2010, Glass et al; 2009a, Blanco et al; 2011), mientras que otros estudios recomiendan su uso de forma profiláctica como neuroprotector en pacientes con encefalopatía hipóxico-isquémica, además de la hipotermia terapéutica (Barks et al; 2010). Este potencial efecto neuroprotector se debería por una parte a su acción anticonvulsivante y por otra a mecanismos como reducción de la demanda metabólica cerebral, disminución del edema cerebral y acción antioxidante (Barks et al; 2010).
Fenitoína (PHT) (Campistol; 2000, Blume et al; 2009, Glass et al; 2009a, Lawrence et al; 2010, Navarro-Carmona et al; 2008, Fenichel; 2010, Vento et al; 2010).
Tiene una eficacia similar al PB, controlando de forma aislada menos del 50% de las crisis, aunque siendo eficaz hasta en el 60% en combinación con PB (Blume et al; 2009, Glass et al; 2009a, Lawrence et al; 2010, Fenichel; 2010). Presenta también riesgo evolutivo de neuroapoptosis (Glass et al; 2009a). Además tiene efectos secundarios importantes como arritmias cardiacas o hipotensión, por lo que su uso como segunda línea en caso de refractariedad al fenobarbital está disminuyendo de forma progresiva (Lawrence et al; 2010).
Una alternativa potencial a PHT es fosfenitoína (PPHT), un profármaco fosforilado de PHT más seguro que ésta para poder realizar una administración intravenosa rápida, con menos efectos secundarios cardiovasculares y menos riesgo de reacciones locales en el punto de inyección, y con la posibilidad de administración intramuscular (Vento et al; 2010).
Benzodiacepinas (BZD) (Campistol; 2000, Blume et al; 2009, Glass et al; 2009a, Lawrence et al; 2010, Navarro-Carmona et al; 2008, Fenichel; 2010, Vento et al; 2010, Castro-Conde et al; 2005).
En el periodo neonatal no está indicado su uso como primera elección debido a la disminución de expresión de receptores GABA y a la especial distribución de sus subunidades en el cerebro del neonato, lo cual resulta en una resistencia primaria a benzodiacepinas (Lawrence et al; 2010).
Se puede utilizar Diazepam (DZP) asociado a PB para conseguir una respuesta más rápida (Vento et al; 2010). Algunos protocolos recomiendan el uso de Midazolam (MDZ) si no existe respuesta a PB, con datos de eficacia desde mínima al 100% de control de crisis (Lawrence et al; 2010). La variabilidad respecto a la eficacia de MDZ en los distintos estudios puede deberse al momento en que se introduce el fármaco, de forma que los estudios en que se inicia de forma precoz muestran mejores cifras de eficacia (Castro-Conde et al; 2005).
Levetiracetam (LEV) (Glass et al; 2009a, Lawrence et al; 2010, Fenichel; 2010, Vento et al; 2010, Ramantani et al; 2011, Khan et al; 2011, Kim et al; 2007, Fürwentsches et al; 2010).
Es un fármaco seguro, con pocos efectos secundarios y escasas interacciones con otros fármacos, por lo que su uso en administración intravenosa para el tratamiento del SE neonatal está aumentando en la práctica clínica rutinaria, incluso como fármaco de primera línea (Lawrence et al; 2010, Vento et al; 2010, Ramantani et al; 2011, Khan et al; 2011, Fenichel 2010).
Su principal atractivo es el hecho de que LEV no produce neuroapoptosis en modelos animales, ya sea utilizado en monoterapia o combinado con PHT, e incluso ha demostrado disminuir la degeneración neuronal producida por hipoxia o por las propias crisis (Vento et al; 2010, Kim et al; 2007, Fürwentsches et al; 2010). Además, su farmacocinética lineal con escasa unión a proteínas, la eliminación renal sin paso hepático y su absorción rápida y casi completa por vía oral, hacen que su uso sea sencillo tanto de forma parenteral como por vía oral (Fürwentsches et al; 2010, Ramantani et al; 2011).
Valproato sódico (VPA) (Campistol; 2000, Glass et al; 2009a, Lawrence et al; 2010, Fenichel; 2010, Vento et al; 2010, Blume et al; 2009, Navarro-Carmona et al; 2008)
VPA se ha mostrado claramente eficaz en crisis neonatales y SE, como FAE de primera o segunda línea (Campistol; 2000), aunque su potencial riesgo de hepatopatía, encefalopatía, hiperamoniemia, posibilidad de empeorar metabolopatías congénitas y la demostración en estudios animales de muerte neuronal por apoptosis, con regresión en reflejos específicos y cambios comportamentales, limitan actualmente su empleo en las crisis neonatales (Kim et al; 2007, Forcelli et al; 2010).
Lidocaína (LDC) (Campistol; 2000, Glass et al; 2009a, Lawrence et al; 2010, Fenichel; 2010, Vento et al; 2010, Blume et al; 2009, Navarro-Carmona et al; 2008).
Es un fármaco muy eficaz en perfusión continua intravenosa en el tratamiento de las crisis refractarias en periodo neonatal (Campistol; 2000), pero su toxicidad cardiaca inherente, que obliga a una monitorización estrecha por el riesgo de arritmias ventriculares, ha limitado mucho su uso (Vento et al; 2010, Lawrence et al; 2010).
Topiramato (TPM). (Glass et al; 2011, Lawrence et al; 2010, Fenichel; 2010, Vento et al; 2010, Forcelli et al; 2010).
TPM es un antiepiléptico de amplio espectro que ha demostrado eficacia anticonvulsivante y propiedades neuroprotectoras en modelos animales de daño hipóxico-isquémico, con efectos positivos en cuanto a función cognitiva y nivel de actividad, y reducción del deterioro de memoria y aprendizaje inducido por las crisis (Vento et al; 2010, Kim et al; 2007, Glass et al; 2011, Blanco et al; 2011).
Sin embargo, administrado junto con PB y/o PHT parece que puede exacerbar su neurotoxicidad (Forcelli et al; 2010).
TPM debe utilizarse con precaución ya que no existen aún datos suficientes de eficacia y seguridad en humanos durante el periodo neonatal (Lawrence et al; 2010, Glass et al; 2011).
Lamotrigina (LTG) (Lawrence et al; 2010, Fenichel; 2010, Vento et al; 2010, Katz et al; 2007, Forcelli et al ; 2010, Barr et al; 1999).
Es un fármaco de amplio espectro, bien tolerado en niños y adultos, al cual se han atribuido efectos neuroprotectores cuando se utiliza en monoterapia a dosis terapéuticas. Sin embargo, utilizado a dosis altas provoca daño neuronal difuso y asociado a PB aumenta su efecto neuroapoptótico. (Forcelli et al; 2010, Katz et al; 2007) Respecto a su asociación con PHT el efecto también es dependiente de dosis, de forma que a dosis bajas disminuye la neuroapoptosis inducida por PHT y a dosis altas exacerba su efecto sobre la muerte neuronal. Por tanto, respecto al tema de la neurotoxicidad, es más recomendable la asociación LTG-PHT que la asociación LTG-PB (Katz et al; 2007).
Bumetanida (BMD) (Lawrence et al; 2010, Vento et al; 2010, Vanhatalo et al; 2009, Chabwine et al; 2011).
Es un diurético que actúa sobre el cotransportador de sodio-potasio-cloro creando un gradiente de cloro más similar al de las neuronas adultas, lo cual equilibra la acción del GABA de excitador a inhibidor. Utilizado junto a PB, se cree que puede aumentar su eficacia (Vento 2010). Sin embargo, no existe aún suficiente evidencia sobre el perfil de eficacia y tolerabilidad en humanos y estamos aún lejos de conocer si los hallazgos en modelos animales son extrapolables al neonato (Vanhatalo et al; 2009, Chabwine et al; 2011).
Piridoxina (Devinsky et al; 2008, Lawrence et al; 2010, Campistol; 2000, Gospe; 2006, Basura et al; 2009, Prasad et al; 2006).
Este fármaco debe utilizarse en las crisis neonatales precoces que son refractarias a fármacos antiepilépticos convencionales y en todos los SE neonatales, dado que implican una etiología tratable tanto si se trata de crisis piridoxin-dependientes o bien de crisis respondedoras a piridoxina (Lawrence et al; 2010). En el caso de que se controlen las crisis, posteriormente se puede continuar con dosis de mantenimiento de piridoxina por vía oral.
Piridoxal fosfato (Devinsky et al; 2008, Lawrence et al; 2010, Wang et al; 2005, Pearl et al; 2007).
Debe considerarse su uso en crisis refractarias en edad neonatal y en todos los SE neonatales sin etiología definida (Lawrence et al; 2010). Algunos niños que no responden a piridoxina pueden responder a piridoxal fosfato posteriormente. En los casos que responden a piridoxal fosfato, se puede continuar luego con 10 mg/kg/día de piridoxina oral.
Biotina (Devinsky et al; 2008, Campistol; 2000, Lawrence et al; 2010, Prasad et al; 2006).
Se debe considerar su uso en las crisis neonatales refractarias, encefalopatías epilépticas neonatales y en todos los SE neonatales de origen no filiado (Lawrence et al; 2010).
Ácido folínico (Devinsky et al; 2008, Campistol; 2000, Nicolai et al; 2006, Frye et al; 2003, Prasad et al; 2006, Lawrence et al; 2010).
Se debe considerar su uso en crisis neonatales rebeldes a FAE convencionales y en todos los SE neonatales refractarios, incluyendo las formas sin respuesta inicial a piridoxina ni a piridoxal fosfato ni a biotina (Lawrence et al; 2010).
- Status Epiléptico en el niño.
El Status Epiléptico (SE) en la infancia ha experimentado cambios conceptuales, diagnósticos y terapéuticos muy llamativos a lo largo de la última década.
-Definiciones del SE en la infancia.
La primera definición de SE aparece ya en el siglo XIX como una situación en la que las crisis de Gran Mal ocurren en rápida sucesión sin existir una recuperación completa entre las convulsiones (Calmeil; 1824).
Posteriormente, en la segunda mitad del siglo XX, la organización mundial de la salud (OMS) (Gastaut; 1973), la liga internacional contra la epilepsia (ILAE) (Commission on Terminology of the International League Against Epilepsy; 1964), y el profesor Gastaut, en la escuela de epilepsia de Marsella (Francia) (Gastaut; 1970), lo definen como una situación de convulsión persistente en el tiempo, o bien cuando las crisis comiciales se repiten frecuentemente sin permitir recuperar el nivel de conciencia o la normalidad intercrisis.
Con respecto a la duración de las crisis, la mayoría de los autores aceptaron a finales del siglo XX un tiempo igual o superior a los 30 minutos, dado que se habían identificado lesiones estructurales cerebrales en animales de experimentación con crisis que superaron ese límite temporal (Commission on Classification and Terminology of the International League Against Epilepsy; 1981).
Nuevas definiciones conceptuales de SE.
1. Patocronía de las crisis agudas en el niño: las crisis duran más de 5 minutos en un 50% de los casos, más de 10 minutos en un 29%, más de 20 minutos en un 16%, y más de 30 minutos en un 12% de los casos (Shinnar et al; 2001a). Considerando estos porcentajes, debemos pensar que un niño que llega en convulsión activa al Servicio de Urgencias es o puede ser un SE. Así, cuanto más haya durado la crisis, más difícil va a ser yugularla en los próximos 5-10 minutos. Es decir, una vez que la crisis haya durado más de 5 minutos, será muy raro que pare espontáneamente, por lo cual no se debe dejar pasar más tiempo para tratar (Freilich et al; 2010).
2. Crisis agudas repetitivas y SE: el espectro cronobiológico de las crisis (Cereghino et al; 2007) nos indica que los niños que presentan una crisis aislada pueden desarrollar luego crisis recurrentes y que éstas pueden evolucionar a una situación de crisis agudas repetitivas en las próximas 12-24 horas, con la posibilidad de experimentar crisis prolongadas (entre 10-30 minutos) o incluso llegar al concepto temporal clásico de SE (con una duración mayor o igual a 30 minutos).
3. Nuevo concepto de duración de las crisis en el SE: se ha diseñado un nuevo concepto derivado de la evolución natural de las crisis agudas. Así, por cada minuto que pasa entre el comienzo del episodio y la llegada a urgencias, aumenta un 5% el riesgo acumulativo de que la convulsión dure más de 60 minutos (Chin et al; 2008). Por otra parte, una convulsión que dura más de 5 minutos tiene un mayor riesgo evolutivo de durar 30 minutos o más (Eriksson et al; 2005). Por todo ello, se considera que el concepto real de SE en el niño se debe dirigir a aquellos episodios convulsivos con una duración mayor o igual a 5 minutos o que se repiten con frecuencia tal que impide la recuperación de la conciencia entre los episodios (Freilich et al; 2010).
4. Concepto de SE refractario: es aquel SE en el que las crisis duran más de 60 minutos, a pesar del tratamiento inicial de choque bien protocolizado (Owens; 2010, Shorvon; 2011a). Esta forma refractaria ocurre hasta en un 30% de los casos de SE y es más frecuente en los SE no convulsivos y en los SE de crisis focales motoras (Shorvon; 2011b).
-Fisiopatología del SE en la infancia.
El mantenimiento de la actividad epiléptica en el SE, una vez finalizado el estímulo epileptógeno, se debe a dos fenómenos de maladaptación (Goodkin et al; 2008), como son: la disminución de la inhibición mediada por el GABA y el incremento de la excitabilidad glutaminérgica con activación excesiva de receptores NMDA.
El daño neuronal que sigue al SE vendría determinado por alteraciones diversas como son: disfunción mitocondrial, fracaso energético celular, neuroapoptosis e inducción de actividad inflamatoria por el propio SE (Vezzani et al; 2009).
-Epidemiología del SE en la infancia.
La incidencia global del SE infantil oscila entre 4-8 casos por cada 1000 niños (Appleton et al; 2000). La incidencia anual de SE en niños varía de 10 a 58 casos por cada 100.000 pacientes menores de 18 años, lo cual implica unos 31.600 casos de SE en los menores de 18 años en USA cada año (Riviello et al; 2006).
En la edad pediátrica, las cifras más elevadas de incidencia de SE están en el grupo de edad menor de 2 años, donde se obtienen tasas de SE más de 10 veces superiores a las de los adultos (Shinnar et al; 1997). Un 21% de los SE ocurren durante el primer año de vida y hasta el 64% se presentan agrupados durante los 5 primeros años de vida (Shinnar et al; 1997, Riviello et al; 2006). En hasta en un 57% de los casos se trata de SE febriles (Chin et al; 2006).
En un 12% de los casos de primera crisis en el niño ésta es un SE (Appleton et al; 2000). Sólo un 25-28% de los SE infantiles tienen antecedentes de epilepsia (Asadi-Pooya et al; 2005).
Un 0,5-1% de los pacientes con epilepsia conocida tienen un episodio de SE por año y hasta un 20-30% de los epilépticos tendrán un SE en los 5 primeros años tras ser diagnosticados de epilepsia (Riviello et al; 2006). Hasta un 17% de los SE infantiles es recidivante, un 11% de ellos durante los 12 primeros meses, el 18% en 24 meses y el 20% entre 36-48 meses, siendo el intervalo medio de unos 10 meses entre el primer y el segundo SE en el niño (Riviello et al; 2006).
-Clasificaciones del SE en la edad pediátrica.
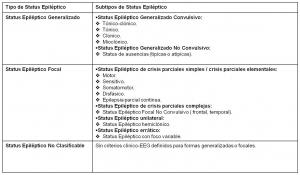
Las definiciones del SE por parte de la OMS y la ILAE permiten realizar una clasificación del SE similar a la que se emplea para las crisis convulsivas, utilizando criterios de semiología clínica y electroencefalográfica (Commission on Terminology of the International League Against Epilepsy; 1964, Gastaut; 1970, Gastaut; 1973, Commission on Classification and Terminology of the International League Against Epilepsy; 1981). En esta clasificación, se diferencian preferentemente los SE generalizados y los SE focales y en cada uno de estos 2 grupos se describen formas convulsivas y formas no convulsivas (ver “clasificación del SE según la ILAE y la OMS. jpg”).
Por otra parte, Lüders (Lüders et al; 2005) insiste en la necesidad práctica de clasificar los SE exclusivamente en base a la semiología de las crisis epilépticas (ver “clasificación semiológica del SE. jpg”).
-Etiología del SE en la infancia.
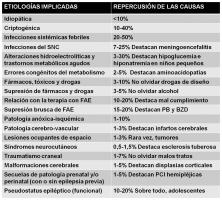
Se distinguen 5 grandes grupos etiopatogénicos de SE en el niño, incluyendo SE criptogénicos, SE sintomáticos remotos (con o sin precipitantes), SE febriles, SE sintomáticos agudos, y SE de las encefalopatías progresivas (Riviello et al; 2006). Globalmente, predominan los SE febriles y los SE de origen sintomático agudo.
1- SE sintomático Agudo.
Suponen un 25-35% de los SE. Aparecen en el contexto de una enfermedad aguda o encefalopatía aguda (infección del SNC, tóxicos, hipoxia, isquemia, trauma, etc.).
2- SE febril.
SE coincidente con fiebre sin evidencia de infección del SNC ni signos de enfermedad sistémica febril grave. Suponen hasta un 25-50% de los casos en niños menores de 3 años.
3- SE sintomático remoto sin precipitantes agudos.
Representan un 33-37% de los SE. Se presentan en pacientes con daño neurológico previo o encefalopatía crónica sin precipitantes agudos (malformación del SNC, secuelas de encefalopatía hipóxico-isquémica neonatal, cromosomopatía, etc.).
4- SE sintomático remoto con precipitante agudo.
Agrupan un 10-15% de los SE. Son pacientes con daño neurológico previo o encefalopatía crónica con diagnóstico previo de epilepsia, pero con precipitantes agudos evidentes (por ejemplo, niños con parálisis cerebral infantil con precipitante como infección, hipoglucemia, hiponatremia, tóxicos, etc.).
5- SE de las encefalopatías progresivas.
Suponen un 3-5% de los SE. En el contexto de patología progresiva del SNC (enfermedad mitocondrial, metabolopatías congénitas, enfermedades de depósito, etc.).
6- SE criptogénico.
Son un 15-20% de los SE. Sin causa definible y sin precipitantes conocidos.
En el niño, puede encontrarse una etiología definida del SE hasta en un 65-80% de los casos (Riviello et al; 2006, Chin et al; 2006, Asadi-Pooya et al; 2005). Las causas del SE en el niño son tan variadas como las propias de las crisis epilépticas ocasionales y las de la propia epilepsia (ver “etiología del SE en el niño. jpg”).
Conforme avanza la edad del niño, las etiologías se van asemejando a las propias del adulto. Así, mientras que en los 3 primeros años de vida predominan los SE febriles y los SE de las encefalopatías sintomáticas agudas; en los niños de 4 a 14 años, predominan los SE criptogénicos y los SE debidos a una encefalopatía sintomática crónica (Chin et al; 2006).
Por otra parte, es importante conocer que en el niño se pueden presentar SE especiales como son los asociados con las encefalopatías epilépticas con SE de espasmos epilépticos, crisis atónicas, crisis astáticas, mioclonías epilépticas, crisis gelásticas y/o mioclonus negativos (Lüders et al; 2005).
- Riesgo de SE en el paciente epiléptico conocido.
Se barajan diversos factores de riesgo de desarrollo evolutivo de SE en este grupo, incluyendo: etiología sintomática remota, retraso mental asociado a la epilepsia, debut de la epilepsia en el primer año de vida, epilepsia focal (sobre todo, si crisis parciales secundariamente generalizadas), epilepsia mioclónica, antecedente de crisis neonatales, tratamiento en politerapia, supresión brusca de FAE, cumplimiento irregular del tratamiento, presencia de encefalopatía epiléptica en el patrón de EEG, y RM cerebral con alteraciones difusas (Karasalihoglu et al; 2003, Fountain; 2000).
-Clínica del SE en el niño.
Distinguiremos aquí formas de SE convulsivo (generalizado o focal) y de SE no convulsivo (de crisis parciales complejas o de ausencias).
SE convulsivo generalizado.
Es el más común y el más grave de todos los SE (Shorvon; 2005). Se da más en casos con retraso mental y en pacientes con lesiones frontales. Puede ocurrir como inicio de una epilepsia o bien en pacientes epilépticos ya conocidos. En el niño, es frecuente que ocurra como primera manifestación convulsiva y suele asociarse a fiebre (SE febril). Se caracteriza por movimientos tónicos, clónicos, tónico-clónicos o bien mioclónicos continuos asociados a alteración importante del nivel de conciencia o coma con descargas paroxísticas generalizadas en el EEG.
Mención aparte merecen los SE mioclónicos generalizados que se ven sobre todo en niños con encefalopatías epilépticas o en casos de encefalopatías postanóxicas y que deben diferenciarse de encefalopatías graves con mioclonías no epilépticas mediante el empleo de registro EEG crítico (Elia; 2009).
SE convulsivo focal.
Se caracteriza por crisis focales repetidas sin deterioro evolutivo del nivel de conciencia (Chiron et al; 2004). El EEG crítico puede mostrar descargas irritativas focales unilaterales o bien puede ser normal si el área cortical es muy pequeña. Se han descrito SE motores, sensitivos, somatomotores y disfásicos. La forma más grave en este grupo de SE es la epilepsia parcial continua, con crisis focales motoras simples continuas clónicas y mioclónicas.
SE no convulsivo con ausencias.
Se distinguen dos tipos sindrómicos, incluyendo el SE que se presenta en el niño con ausencias típicas y el que se presenta en niños con encefalopatías epilépticas con crisis de ausencias atípicas (Chiron et al; 2004).
En algunos pacientes, la introducción o la supresión brusca de determinados fármacos (principalmente, benzodiacepinas), el empleo de psicofármacos o la presencia de alteraciones metabólicas agudas pueden precipitar el SE de ausencias (Arzimanoglou et al; 2011). Es importante, tener especial precaución con determinados FAE en el tratamiento de epilepsias generalizadas idiopáticas, principalmente respecto a TGB, VGB, GBP, CBZ, y OXC (Fernández-Torre; 2006).
SE no convulsivo de crisis parciales complejas.
Se caracteriza por la aparición de crisis parciales complejas repetidas y se manifiesta por disminución del nivel de conciencia, confusión mental, amnesia y alteraciones en la conducta, con o sin automatismos asociados (Tay et al; 2006, Chiron et al; 2004).
En su origen, se distinguen formas mesiales temporales y también formas frontales. Estas últimas pueden dar un cuadro de encefalopatía más difusa con coma de origen no filiado, principalmente en adultos y ancianos (Fernández-Torre et al; 2003).
-Grupos especiales de SE.
Analizaremos en este apartado el SE febril, cuadro exclusivo de la edad pediátrica, y el SE de pseudocrisis, por su complicado diagnóstico diferencial.
SE febril.
Es una importante causa de SE, sobre todo en menores de 3 años de edad. Hasta un 42% se pueden comportar como SE refractarios y se presentan signos focales hasta en un 35% de los casos (Shinnar et al; 2001b). Tienen antecedentes familiares de epilepsia hasta en un 11% de los casos. Muestran una baja tasa global de morbi-mortalidad respecto a otros cuadros de SE infantil.
SE de pseudocrisis o pseudo-status epiléptico.
Representan un 7,5-18% de todas las pseudocrisis (Dworetzky et al; 2006). Suelen tener episodios previos similares. Son frecuentes las alteraciones de personalidad. Se da más en adolescentes de sexo femenino. No es inhabitual que exista una epilepsia previa ya controlada. Los datos clínicos que deben hacer sospechar esta entidad incluyen: ausencia de lesiones como mordedura o traumatismos, vocalización frecuente, postura en opistótonos, fluctuaciones en intensidad de las posturas y movimientos, resistencia a la exploración física en el momento de la crisis, comportamiento bizarro de la semiología crítica (ojos cerrados, movimientos incoordinados de miembros y semiología no concluyente), y ausencia de signos de postcrisis.
-Complicaciones del SE en el niño.
Se distinguen muy diversas complicaciones neurológicas y sistémicas en el niño, lo cual sigue condicionando una alta tasa de morbi-mortalidad a pesar de los avances terapéuticos (Fountain; 2000, Asadi-Pooya et al; 2005).
Complicaciones cardiovasculares.
Se incluyen aquí taquicardia, bradicardia, arritmias cardiacas, parada cardiaca, alteraciones de la conducción cardiaca, insuficiencia cardiaca congestiva, hipertensión arterial y/o hipotensión arterial.
Complicaciones respiratorias.
En forma de patrones respiratorios anómalos, apneas, parada respiratoria, edema pulmonar, distrés respiratorio del adulto, neumonía, aspiración pulmonar y/o laringoespasmo.
Complicaciones renales.
Existen anomalías diversas como oliguria, anuria, uremia, necrosis tubular renal aguda, síndrome nefrítico agudo y/o rabdomiolisis con mioglobinuria. Complicaciones endocrinológicas.
En forma de hipopituitarismo, aumento de prolactina, aumento de vasopresina, hipoglucemia, hiperglucemia y/o aumento del cortisol plasmático.
Alteraciones en el control del medio interno y sistema nervioso autónomo.
Se han descrito anomalías variadas como anoxia, hipoxia, acidosis metabólica, acidosis respiratoria, deshidratación, hiponatremia, hipernatremia, hipopotasemia, hiperpotasemia, hipocalcemia, hipercalcemia, hipertermia, sudoración excesiva y pandisautonomía.
Complicaciones hematológicas.
Principalmente como coagulación intravascular diseminada (CID).
Complicaciones neurológicas.
Destaca el desarrollo de edema cerebral refractario al tratamiento y la narcosis por hipercapnia.
DIAGNÓSTICO DEL STATUS EPILÉPTICO EN LA EDAD PEDIÁTRICA.
El diagnóstico del SE es fundamentalmente clínico, aunque en ocasiones necesita de la información complementaria del EEG para realizar el diagnóstico diferencial con otros cuadros neurológicos agudos que pueden simular un SE del tipo parcial complejo (intoxicaciones, encefalitis, metabolopatías, etc.) y para definir el tipo sindrómico de SE (principalmente, en los casos de SE no convulsivo) (Fernández-Torre et al; 2003).
Una vez que se ha estabilizado el paciente y se ha controlado la actividad convulsiva, se debe investigar la posible etiología del status (diagnóstico etiológico del SE). En Urgencias, es fundamental reconocer que pacientes necesitan una tomografía axial computarizada (TAC) craneal y/o una punción lumbar no diferidas (Hirtz et al; 2000, Hirtz et al; 2003, Riviello et al; 2006).
-El valor de las pruebas complementarias.
Se incluyen aquí pruebas analíticas, de neuroimagen, punción lumbar y EEG, que nos dan información adicional sobre la etiopatogenia del SE.
Punción lumbar y examen del líquido cefalorraquídeo (LCR).
No se debe hacer de rutina (nivel U de evidencia). Tiene una mínima o nula rentabilidad en SE afebriles. Se debe excluir previamente la presencia de un síndrome de hipertensión intracraneal (HIC) con examen de fondo de ojo y/o TAC craneal. Se debe hacer siempre que se sospeche una infección del SNC, en todo status coincidente con fiebre, y en todo status de crisis neonatales (Riviello et al; 2006, Hirtz et al; 2000, Hirtz et al; 2003). Sólo en un 12% de los casos de SE febriles se encuentra una meningitis bacteriana (Chin et al; 2006). Por otra parte, se debe recordar que hasta un 20% de los pacientes tienen pleocitosis reactiva después de una convulsión prolongada (Hirtz et al; 2000, Hirtz et al; 2003).
TAC craneal.
Se debe estabilizar previamente al niño antes de hacer la TAC. No se debe hacer de rutina y sin indicación definida (nivel U de evidencia). Se encuentran anomalías en un 30-70% de los SE (Sharma et al; 2003). Se debe realizar en los SE focales, en SE con focalidad en la postcrisis, cuando se sospeche un síndrome de HIC, en todo SE tras trauma craneal y en todo SE de neonatos y lactantes (Riviello et al; 2006, Hirtz et al; 2000, Hirtz et al; 2003, Sharma et al; 2003).
Resonancia magnética cerebral (RM cerebral).
Aunque existen limitaciones técnicas y organizativas para su empleo rutinario en el SE, la RM cerebral es de gran utilidad dado que evidencia alteraciones estructurales como causa del SE y también da información funcional por la presencia de anomalías hiperintensas en secuencias T2 y FLAIR y en el estudio de difusión en regiones corticales tras SE, que suelen normalizarse en el curso de 3-12 meses (Kavuk et al; 2005).
Tomografía computarizada por emisión de fotón único (SPECT)
Puede ser útil su empleo en fase ictal en casos de SE no convulsivos con localización dudosa del área epileptógena en el EEG y datos de RM cerebral poco claros por la extensión de las anomalías en el estudio de difusión (Kutluay et al; 2005).
Analíticas específicas. (Riviello et al; 2006, Hirtz et al; 2000, Hirtz et al; 2003, Freeman; 2003).
1. Determinación de tóxicos: se debe hacer siempre que no haya una etiología evidente en la primera valoración etiológica (nivel C de evidencia). Se realizará siempre en sangre y orina. No es útil hacer un triage aislado en orina (sólo vale para excluir drogas de abuso).
2. Hemocultivos: no se deben hacer de rutina (nivel U de evidencia). Se realizará sólo si existe alta sospecha de infección sistémica o en caso de SE febriles en lactantes y niños menores de 2 años.
3. Niveles de FAE: se debe considerar en todo niño epiléptico tratado con FAE de forma crónica (nivel B de evidencia). Se objetivan niveles bajos de antiepilépticos hasta en el 32% de los SE en epilépticos que tomaban FAE, pero no se conoce a ciencia cierta si ésta es la única causa del SE en estos pacientes (Riviello et al; 2006).
4. Estudios de metabolismo calcio-fósforo: se debe valorar realizar esta prueba en neonatos y lactantes (nivel C de evidencia).
5. Estudio de metabolopatías congénitas (muestras en paralelo de suero, orina y LCR, para determinación de aminoácidos, ácidos orgánicos, amonio, lactato, piruvato, cuerpos cetónicos y acilcarnitinas). Se realizarán siempre que no haya una etiología evidente en la primera valoración etiológica (nivel C de evidencia). No se debe hacer de rutina (nivel U de evidencia). Es más rentable estudiar esta etiología en neonatos, lactantes y en casos de síndromes encefalíticos, ataxia o coma no filiados asociados al SE.
6. Estudios genéticos: se deben reservar para casos sin etiología definida tras una valoración inicial exhaustiva. No se considera hacer estos tests de forma rutinaria (nivel U de evidencia).
Electroencefalograma (EEG). (Riviello et al; 2006, Hirtz et al; 2000, Hirtz et al; 2003, Freeman; 2003, Freilich et al; 2010).
No es habitualmente una prueba urgente, a no ser que se tengan dudas sobre el origen comicial del episodio paroxístico (TPNE y pseudocrisis).
Tienen poco valor las anomalías EEG que se observan en las primeras 24-48 horas tras el SE, incluyendo: lentificación global del trazado y sobrecarga de ritmos rápidos medicamentosos. Es fundamental realizar controles evolutivos de EEG.
Se han descrito patrones intercríticos diversos como anomalías generalizadas (8-10%), alteraciones focales (15-20%), lentificación generalizada del trazado (40-45%), lentificación focal (5-10%), trazado hipoactivo (1-3%), o bien un patrón EEG normal (7-10%) (Riviello et al; 2006, Freeman; 2003, Freilich et al; 2010).
. La investigación de un EEG crítico en el SE está indicado para definir el tipo electro-clínico del SE y orientar mejor el futuro tratamiento de mantenimiento, principalmente en aquellos casos en los que se sospecha la existencia de un SE no convulsivo y cuando se quiere excluir un pseudo-status epiléptico (Freeman; 2003).
PRONÓSTICO DEL STATUS EPILÉPTICO EN LA EDAD PEDIÁTRICA
Hasta un 60% de los casos está libre de morbi-mortalidad (Asadi-Pooya et al; 2005, Arzimanoglou; 2007). La tasa de recurrencia en el primer año llega hasta el 16% (Chin et al; 2006).
-Mortalidad del SE en el niño.
La mortalidad global del SE es más baja en el niño (3-15%) que en el adulto (15-49%) (Asadi-Pooya et al; 2005, Arzimanoglou; 2007). Las formas con más alta tasa global de mortalidad infantil por SE se asocian con encefalopatías agudas graves y con encefalopatías progresivas (Asadi-Pooya et al; 2005, Arzimanoglou; 2007). La mortalidad es globalmente baja en el grupo de SE febriles y en los SE idiopáticos (Asadi-Pooya et al; 2005). Por otra parte, la mortalidad es muy elevada en el grupo de niños con SE refractario, donde puede alcanzar el 32% (Sahin et al; 2001).
-Pronóstico global del SE en el niño.
No parece haber relación con la edad o el sexo (Asadi-Pooya et al; 2005, Arzimanoglou; 2007). Los factores que más influyen sobre el pronóstico global del SE son la etiología del mismo (Asadi-Pooya et al; 2005, Arzimanoglou; 2007, Claassen et al; 2002) y el tiempo que transcurre desde el inicio del SE hasta que se instaura el tratamiento médico (Asadi-Pooya et al; 2005, Arzimanoglou; 2007).
Con respecto a la etiología de SE, se valoran dos grupos distintos de pacientes, con o sin patología estructural del SNC (Leppik; 1985, Wilder; 1983, Asadi-Pooya et al; 2005). El tipo I de Leppik o grupo A de Wilder lo constituyen aquellos casos sin patología estructural del SNC. Tienen mejor pronóstico global y hasta un 80% de ellos se controla totalmente a los 20 minutos de administrar fenitoína i.v. El tipo II de Leppik o grupo B de Wilder incluye aquellos pacientes con patología intracraneal grave estructural como hemorragias, encefalitis, encefalopatías por tóxicos e infarto cerebral. Su peor pronóstico se debe al daño cerebral persistente secundario a la patología de base.
-Secuelas evolutivas del SE en el niño.
Las secuelas a largo plazo del SE se relacionan estrechamente con la etiología del SE (principalmente, formas con encefalopatía aguda grave y niños con encefalopatías progresivas) y con la edad (peor pronóstico global en niños menores de 1 año) (Asadi-Pooya et al; 2005, Arzimanoglou; 2007, Claassen et al; 2002). Existen secuelas en un 29% de los menores de 1 año frente a sólo en un 6% en los mayores de 3 años (Asadi-Pooya et al; 2005, Claassen et al; 2002). Algunos autores consideran también un factor pronóstico desfavorable la duración del SE superior a 60 minutos (Hui et al; 2003). Existe claramente una mayor morbilidad en pacientes con ingreso hospitalario prolongado (Asadi-Pooya et al; 2005, Hui et al; 2003).
Entre las secuelas evolutivas que pueden afectar hasta a un 40-67% de los niños con SE, se describen, entre otras (Asadi-Pooya et al; 2005, Claassen et al; 2002) déficits motores (parálisis, ataxia, distonía, hipotonía, temblores, etc.), alteraciones neurocognitivas (retraso mental, déficits mnésicos y de lenguaje) y patologías conductuales o comportamentales (principalmente, hiperactividad e inatención).
TRATAMIENTO DEL STATUS EPILÉPTICO EN EL NIÑO.
Es fundamental realizar una buena valoración clínica inicial previa al tratamiento, estabilizar adecuadamente al paciente, realizar una actividad terapéutica bien protocolizada y conocer bien las indicaciones, la cinética y las dosis de los distintos FAE.
El SE es una emergencia médica que debe incluir 3 objetivos prioritarios de tratamiento (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000): 1) detener la actividad convulsiva; 2) mantener la homeostasis interna; y 3) tratar las posibles complicaciones derivadas del SE.
Nuestra actuación terapéutica en la convulsión aguda se realizará siempre de forma protocolizada y escalonada para dar respuesta a esos 3 objetivos básicos.
1. Se debe organizar la actividad médica de una forma metódica y sin precipitaciones.
2. Debemos evitar las manipulaciones bruscas.
3. Es fundamental asegurar una correcta oxigenación cerebral y una adecuada función cardio-respiratoria. Se comprobará la permeabilidad de la vía aérea y se instaurará un aporte de oxígeno por cánula nasal o mascarilla. Se valorará precozmente la necesidad de asistencia respiratoria y se dispondrá de un ambú y del material necesario para la intubación.
4. Se identificará el tipo de crisis comicial por observación de la semiología ictal y tras procesar la información aportada por la familia sobre la historia clínica básica de la convulsión aguda.
5. Se procederá a canalizar una vía de perfusión intravenosa (i.v.). Se emplearán inicialmente soluciones glucosadas, hasta recibir los resultados de la glucemia. Se debe valorar, de forma individualizada, extraer una analítica de sangre elemental, que incluya: hemograma completo, ionograma, glucemia, calcio, urea, creatinina, gasometría y coagulación. Si no se logra un acceso i.v. inmediato, se deben valorar otras rutas de administración de fármacos y/o perfusión como son la vía rectal (v.r.), intratraqueal (i.t.), intranasal (i.n.), bucal (v.b.) y la vía intraósea (i.o.).
6. Para yugular la crisis convulsiva emplearemos fármacos de primer nivel y de segunda y tercera línea de tratamiento, según cada edad y tipo de crisis (ver más adelante en el texto). Por otra parte, consideraremos nuestra actuación farmacológica evolutiva para prevenir la recurrencia de las crisis comiciales. Los fármacos de acción rápida i.v. (benzodiacepinas) tienen una vida media muy corta y habitualmente se requiere complementar su uso con dosis de carga de fármacos de acción más prolongada (por ejemplo, fenitoína).
7. Es fundamental detectar y corregir los posibles precipitantes del SE, incluyendo la corrección de la hipoglucemia mediante la administración de soluciones parenterales glucosadas; el control de la hipertermia con la administración precoz de antitérmicos (preferentemente por v.r. o por vía i.v.); y la evaluación y tratamiento de otros posibles factores como alteración hidroelectrolítica, acidosis, posibles tóxicos y deprivación de éstos (alcohol) y alteraciones derivadas del mal uso o abuso de la medicación con FAE.
8. Asegurar un correcto aporte de líquidos parenterales, evitando la hiperhidratación, por el riesgo de edema cerebral inherente a todo SE. Se debe garantizar un correcto aporte calórico. Regularemos los aportes de electrolitos en función de los resultados del ionograma, evitando soluciones hipotónicas por el riesgo potencial de síndrome de secreción inadecuada de ADH (SIADH). No es necesario emplear bicarbonato sódico, salvo en el caso de acidosis metabólicas severas.
9. Se instaurarán medidas de prevención y tratamiento del edema cerebral, incluyendo una buena oxigenación tisular cerebral manteniendo cifras adecuadas de pO2 y pCO2 y un correcto balance hidroelectrolítico. Puede ser necesario administrar solución salina hipertónica o manitol en casos de edema cerebral establecido. En formas de edema cerebral refractario, se debe considerar respiración asistida con hiperventilación y pentobarbital i.v. o bien la realización de hipotermia corporal. No existe evidencia sobre la utilidad de los corticoides como medida efectiva frente al edema cerebral (Abend et al; 2010).
-Medidas de acción farmacológica para la convulsión aguda y el SE.
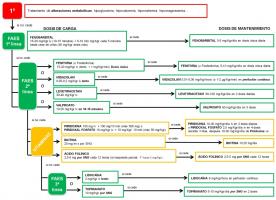
Se emplean muy diversos fármacos de forma escalonada y protocolizada, con unas dosis de carga y mantenimiento bien definidas (ver “fármacos usados para el tratamiento del SE en el niño. jpg”)
, (ver “pauta de actuación en el SE.jpg”).
El fármaco anticonvulsivo ideal para tratar la convulsión aguda sería aquel que controlara las crisis rápidamente en el 100% de los casos, pudiera administrarse por vía parenteral sin problemas de preparación ni dilución, no alterara la frecuencia respiratoria ni presentara efectos depresores sobre el SNC y no causara efectos adversos cardiovasculares (Abend et al; 2010). En la actualidad, no disponemos de un fármaco con estas características y debemos emplear los fármacos de forma protocolizada y racional. Fármacos de primer nivel.
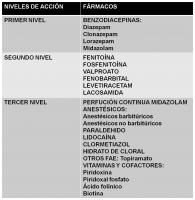
Son fármacos de acción rápida y de vida media corta. En este grupo, se incluyen principalmente las benzodiacepinas (BZD) (ver “FAE primer nivel SE.jpg”).
1. Benzodiacepinas (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Riss et al; 2008). Se incluyen en este grupo diazepam (DZP), clonazepam (CNZ), lorazepam (LZP) y midazolam (MDZ). Como ventajas del grupo, destacan: acción potente y rápida, potencian el GABA (mecanismo inhibidor del SE), amplio rango de duración de efectos (MDZ: 5-10 min, DZP: 15-30 min, LZP: 12-24 h). Como defectos globales, destacan: tolerancia evolutiva, redistribución tisular tras dosis repetidas (se acumulan en los adipocitos), pueden dar depresión respiratoria, alteran la consciencia, potencial hipotensión, reacciones locales tras su administración i.v. (flebitis).
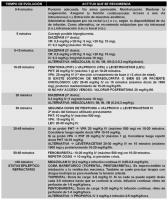
Diazepam (DZP) (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Fitzgerald et al; 2003, Riss et al; 2008, Choudhery et al; 2006). Se obtiene control de las crisis en hasta un 75-90% de los casos (Brown et al; 1991, Abend et al; 2010, Appleton et al; 2008). Está disponible para uso i.v. y para v.r. También puede administrarse a través del tubo endotraqueal y mediante perfusión continua. Tiene una rápida acción anticomicial (3 minutos tras la infusión i.v. y 5-7 minutos tras la administración por v.r.). Pueden repetirse varias dosis (hasta un máximo de 3), según la respuesta anticomicial que se obtenga. Es eficaz en todo tipo de SE convulsivos, aunque deberemos extremar las precauciones en el síndrome de Lennox-Gastaut, ya que puede agravar el SE de crisis tónicas. Sus principales desventajas son la inducción de depresión respiratoria (sobre todo si se usa asociado a fenobarbital) y su corta duración de acción (en torno a 30 minutos). Debe complementarse su uso con un fármaco de duración prolongada (por ejemplo, fenitoína), para evitar la recurrencia de las crisis. Puede producir flebitis local en el sitio de infusión (por efecto del disolvente etilenglicol). Tiene una gran utilidad el gel rectal que es fácil y seguro de administrar y muy útil si no hay acceso iv precoz (evidencia clase B) (Fitzgerald et al; 2003, Appleton et al; 2008).
Clonazepam (CNZ) (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Riss et al; 2008). Es de uso i.v. exclusivo. Es 10 veces más potente que el DZP. Pueden repetirse varias dosis, según la respuesta anticomicial que se obtenga. Se caracteriza por su rápida acción y por presentar una vida media muy corta. Al igual que ocurre con el DZP, debe complementarse su uso con un fármaco de duración prolongada. Tiene un menor riesgo de depresión respiratoria que el DZP. Sus principales desventajas son la broncorrea y la corta duración de acción. En casos de SE refractarios, puede utilizarse mediante perfusión continua i.v. Sigue siendo una opción válida, como alternativa a otras BZD, en el manejo del SE no convulsivo.
Lorazepam (LZP) (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Riss et al; 2008, Choudhery et al; 2006). Es de uso i.v. exclusivo, altamente eficaz en una o varias dosis secuenciales (nivel de evidencia clase C) (Appleton et al; 2008). Esta forma de administración parenteral no está comercializada aún en España. El LZP tiene un potente efecto anticomicial, similar al DZP, pero con una acción más rápida y efectos más duraderos (Choudhery et al; 2006). Necesita también complementarse con un FAE de segundo nivel, con vida media prolongada. Como efectos adversos reseñables del LZP destacan los EA inflamatorios locales (por el disolvente propilenglicol), la hipoventilación central y los vómitos. Tiene menos depresión respiratoria que DZP e igual o superior eficacia (nivel de evidencia clase A) (Appleton et al; 2008).
Midazolam (MDZ) (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Riss et al; 2008). Puede emplearse por vía i.v., por v.r., por vía intranasal (i.n.), por vía bucal (v.b.) y por vía intramuscular (i.m.), en una o varias dosis secuenciales; o bien en perfusión continua intravenosa. Es una molécula hidrosoluble, con rápido inicio de acción en todas sus vías de administración, no produce reacciones locales tras administrar i.v. y tiene poco riesgo de acumulación en el organismo (salvo en neonatos). Su principal inconveniente es que tiene una vida media corta. Al igual que las otras BZD, necesita complementarse con un FAE de segundo nivel para evitar recurrencias de crisis. Es mejor tolerado globalmente que el resto de las BZD y con menor riesgo de depresión respiratoria. Analizaremos aquí la experiencia con las distintas formas galénicas de MDZ.
El MDZ por vía i.n. es una excelente novedad terapéutica para el manejo del SE en el niño, con una importante serie de ventajas, incluyendo: que evita las connotaciones personales y sociales desfavorables del estigma de la administración rectal (Mc Mullan et al; 2010, Wolfe et al; 2006), que lo puede usar el propio paciente en crisis parciales simples (Mc Mullan et al; 2010, Wolfe et al; 2006), y que no produce reacciones cardiorespiratorias graves (Mc Mullan et al; 2010, Mittal et al; 2006, Bhattacharyya et al; 2006). Es una buena opción para un correcto tratamiento prehospitalario inicial (Mc Mullan et al; 2010). Se consigue yugular las crisis hasta en un 89% de los casos con excelente tolerabilidad (Mc Mullan et al; 2010). El MDZ i.n. es igual de eficaz que DZP i.v. (88% vs. 92% de respuestas con control de crisis, respectivamente) en estudios aleatorizados (Mc Mullan et al; 2010, Mittal et al; 2006). Por otra parte, resulta más eficaz que DZP v.r. (96,7% vs. 88,5% de respuestas con control de crisis, respectivamente) y con menos efectos adversos globales (Mc Mullan et al; 2010; Wolfe et al; 2006, Bhattacharyya et al; 2006). Además, existen mejores tiempos globales de acción para MDZ i.n. vs. DZP i.v. dado que no se necesita que coger vía intravenosa (Mc Mullan et al; 2010). Se han descrito algunos inconvenientes para la administración de MDZ i.n. incluyendo (Armijo et al; 2004) la potencial dificultad de administración en pacientes con movimientos cefálicos bruscos, la menor absorción del FAE si existe una infección de la vía respiratoria superior y los EA locales irritativos por el pH ácido de la solución. Para evitar esto, se propugna emplear sistemas adaptadores nasales (reducen la cantidad deglutida) y el disolver el MDZ con ciclodextrina (aumenta el pH y disminuye la cantidad a administrar porque aumenta la concentración).
El MDZ por vía bucal (v.b.) es otra buena alternativa con importantes ventajas como la ausencia de EA importantes (Mc Mullan et al; 2010, Mpimbaza et al; 2008, Scott; 2005), su alta eficacia, con hasta un 84% de respuestas en el plazo de 10 minutos (Scott; 2005) y hasta un 50% de respuestas en el SE ya establecido (Kutlu et al; 2003). El MDZ v.b. es claramente superior frente a DZP v.r. (55,9% vs 26,5% de respuestas con control de crisis, respectivamente) (Mc Mullan et al; 2010, Mpimbaza et al; 2008). Por otra parte, el MDZ v.b. no es significativamente inferior a DZP i.v. en el control de las crisis a los 5 minutos de la administración (85% vs. 93.3% de respuestas con control de crisis, respectivamente) (Talukdar et al; 2009) y necesita un tiempo muy inferior para poder iniciar el tratamiento dado que no necesita de una vía i.v. (Mc Mullan et al; 2010). Entre sus escasos inconvenientes, destaca tan sólo su sabor amargo que puede ser molesto en el paciente consciente (Armijo et al; 2004).
El MDZ por vía i.m. representa otra ruta alternativa de administración con grandes ventajas terapéuticas. Se obtienen respuestas en el 90-93% de los tratados, con rápida absorción en el punto de inyección (Shah et al; 2005, Galdames et al; 2006). Se logran respuestas en 5-10 minutos, con una más rápida administración que para DZP i.v. y con igual efectividad clínica que éste (Mc Mullan et al; 2010, Shah et al; 2005).
2. Fenobarbital (PB). Sólo se comporta como FAE de primer nivel en los neonatos, por su especial cinética y metabolismo en este grupo de edad (Brown et al; 1991, Campistol; 2000).
Fármacos de segundo nivel.
Son fármacos de acción tardía y vida media prolongada. En este grupo, se incluyen: fenitoína, fosfenitoína, valproato, fenobarbital, levetiracetam y lacosamida (ver “FAE segundo nivel SE.jpg”).
1. Difenilhidantoína (DPH) o fenitoína (PHT) (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Álvarez et al; 2011). Es de uso i.v. exclusivo. Está indicada para todo tipo de SE convulsivos (controla las crisis en un 40-91% de los casos) (Brown et al; 1991, Appleton et al; 2008, Abend et al; 2010). La combinación de DZP con PHT es tan eficaz como PB (evidencia clase B) (Appleton et al; 2008). No debe emplearse, sin embargo, en los SE tipo status de ausencias, ya que puede agravarlos o bien precipitar un status de crisis tónicas. Alcanza picos de concentración a los 15 minutos de su administración, consiguiéndose un estado de equilibrio a los 60 minutos. No produce depresión respiratoria ni efectos depresores sobre el SNC, lo cual permite valorar adecuadamente la reactividad neurológica del paciente (escala de Glasgow) sin interferencias de la medicación. Debe monitorizarse siempre la frecuencia cardiaca, la tensión arterial y el registro de ECG, por el riesgo de arritmias cardiacas e hipotensión durante su infusión i.v. Precipita al mezclarse con la mayoría de las soluciones parenterales, con la excepción del suero fisiológico, y produce frecuentemente flebitis muy dolorosas en el área de infusión. Como ventajas globales de la PHT destacan (Álvarez et al; 2011): su efecto prolongado de acción y la experiencia consolidada con su empleo en el SE convulsivo. Como defectos e inconvenientes, se describen (Álvarez et al; 2011): necesidad de un ritmo lento de infusión, necesidad de monitorización (ECG y tensión arterial), su comienzo de acción diferido (en torno a 15-30 min), los EA locales (por el disolvente propilenglicol), su pH muy alcalino (pH=12) y su cinética no lineal.
2. Fosfenitoína (PPHT) (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Touchette et al; 2000). No está comercializada aún en España. Se puede administrar por vía i.v. y también por vía i.m. Es un derivado hidrosoluble de la PHT que libera PHT activa a nivel del compartimiento intravascular tras la acción del enzima fosfatasa alcalina. Alcanza niveles efectivos en sangre en unos 20 minutos. Una dosis de 150 mg de PPHT equivale a 100 mg de PHT. En los estudios realizados hasta la fecha, se ha comprobado que la PPHT controla las crisis en un 85% de los casos a los 30 minutos de su infusión i.v. (Brown et al; 1991, Appleton et al; 2008, Abend et al; 2010). No produce depresión respiratoria ni alteración del nivel de conciencia, con lo cual permite una adecuada monitorización del estado postictal. Por otra parte, no produce EA locales tipo flebitis. Entre sus inconvenientes, destaca que es 10 veces más cara que PHT, lo cual limita su uso (Touchette et al; 2000) y además no hay aún estudios comparativos en niños.
3. Valproato sódico (VPA) (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Álvarez et al; 2011, Chen et al ; 2011). Se utiliza para empleo por v.r., vía i.v. o bien en perfusión continua i.v. (ver “perfusión continua de VPA en el SE.jpg”). Su acción por v.r. es más lenta que la conseguida con DZP. Por vía i.v. penetra en el cerebro con una rapidez similar a la conseguida con DZP y superior a la lograda con PHT. Resulta eficaz en el tratamiento del SE en el 81% de los casos (Álvarez et al; 2011, Appleton et al; 2008, Abend et al; 2010; Chen et al; 2011). No se han referido efectos adversos significativos con su empleo en el tratamiento del SE y son excepcionales las alteraciones cardiovasculares como bradicardia o hipotensión. Como norma general, no debe utilizarse en niños con hepatopatías agudas ni en pacientes con errores congénitos del metabolismo y deben extremarse las precauciones en los niños menores de 2 años de edad. Es importante conocer que aumenta los niveles séricos de DZP, PHT y PB. En un estudio aleatorizado que enfrentaba a VPA y PHT (Misra et al; 2006), se observó mayor efectividad en cuanto a control de crisis para VPA (66% versus 42%, p < 0,05) sin diferencias significativas en cuanto al desarrollo de EA. En otro estudio aleatorizado que enfrentaba a VPA y PHT en SE refractario a BZD, se obtuvo una tasa de respuestas del 88% para VPA frente a un 84% para PHT (p > 0,05) (Gilad et al; 2008), sin existir tampoco diferencias respecto a la tasa de EA. En los últimos años, se ha objetivado también la no inferioridad de VPA i.v. frente a una perfusión continua i.v. de DZP en casos de SE refractarios a BZD de primera línea, con una tasa de respuestas de 50% vs 56% (Chen et al; 2011) y de 80% vs 85% (Mehta et al; 2007). Como ventajas globales de VPA, destacan (Álvarez et al; 2011): su efecto prolongado, rápido inicio de acción, cinética lineal, buen perfil cardiovascular, ausencia de EA sedantes, amplio espectro (útil en todos los tipos de SE), y su experiencia clínica en aumento, que le dota de una evidencia clase C (Abend et al; 2010). Como inconvenientes reseñables, se incluyen (Álvarez et al; 2011): potenciales EA graves (hepatotoxicidad, pancreatitis, encefalopatía aguda, hiperamoniemia, trombopenia y descompensación de metabolopatías congénitas) lo cuál condiciona la limitación de su empleo en niños menores de 2 años.
4. Fenobarbital (PB) (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008). Se puede administrar por vía i.v. e i.m. Su comienzo de acción es más tardío que el DZP. Su administración conlleva un riesgo de depresión respiratoria, hipotensión y sedación excesiva. Tiene una acción prolongada, lo cual permite su empleo como fármaco de mantenimiento. No existen diferencias terapéuticas significativas entre el empleo de PB aislado y una pauta combinada de DZP más PHT (Appleton et al; 2000). No obstante, en virtud de los efectos depresores respiratorios y sedantes, se prefiere reservar el PB para SE refractarios a BZD más PHT. Pueden usarse “megadosis” de hasta un total acumulado diario de 80 mg/Kg con mejor respuesta y tolerancia que tiopental (Lee et al; 2006).
5. Levetiracetam (LEV) (Abend et al; 2008, Abend et al; 2010, Appleton et al; 2008, Freilich et al; 2010, Singh et al; 2009, Álvarez et al; 2011, Reiter et al ; 2010, Trinka; 2011). El LEV es uno de los nuevos FAE que se ha incorporado con éxito en el arsenal terapéutico frente a las crisis agudas repetitivas y el SE en el niño, con una tasa global de libres de crisis de un 85-89% (Reiter et al; 2010). Tiene un amplio espectro antiepiléptico (útil en todos los tipos de SE), posee un perfil de eficacia-seguridad bien definido, tiene una cinética lineal, su administración parenteral es sencilla (sin problemas de preparación ni de dilución), no deprime la función respiratoria, carece de efectos cardiovasculares adversos, no tiene efecto depresor sobre el SNC, no descompensa metabolopatías congénitas ni muestra hepatotoxicidad. Actualmente, existe una experiencia en aumento en el SE no convulsivo (evidencia clase D) (Abend et al; 2010, Trinka et al; 2011). Como defectos de este FAE destaca tan sólo la escasa información global acumulada en SE infantil y el desconocimiento sobre los márgenes de dosis en la población pediátrica. Por otra parte, desconocemos si pudiera ser o no útil el empleo de una dosis inicial de “ataque” de 30-50 mg/Kg y el número de dosis de “ataque” que podrían usarse.
6. Lacosamida (LCM) (Abend et al; 2008, Appleton et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Trinka; 2011, Kellinghaus et al; 2011, Höfler et al; 2011). Es un FAE de tercera generación que se ha administrado con éxito en diversos tipos de SE focal (convulsivo y no convulsivo). La experiencia inicial con LCM en el SE es esperanzadora dado que tiene una cinética lineal, no provoca empeoramientos clínicos paradójicos, tiene buen perfil eficacia-tolerabilidad, no produce alteración del nivel de conciencia, no crea depresión respiratoria, no induce alteraciones cardiovasculares ni anomalías en el ECG, no crea reacciones de hipersensibilidad, no altera parámetros de laboratorio, no produce interacciones con FAE de fase aguda, no induce empeoramiento paradójico del EEG, ni produce EA locales significativos. Su perfil está cada vez mejor definido para el manejo del SE focal no convulsivo. Como defectos de este FAE, debemos considerar tan sólo la escasa experiencia pediátrica con LCM en situaciones de SE y crisis agudas, el hecho de que no exista una dosis bien definida en mg/Kg para estas situaciones y las dudas que existen sobre si es conveniente o no el emplear una dosis inicial de “ataque”.
Fármacos de tercer nivel.
Se deben reservar para cuando fracasan los anteriores fármacos de primera y segundo nivel (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008). Cuando se emplean, hay que considerar siempre el potencial riesgo de depresión respiratoria y la necesidad de respiración asistida con ingreso para monitorización en la unidad de cuidados intensivos (UCI) (ver “FAE tercer nivel SE.jpg”).
. 1. Perfusión continua de MDZ i.v. (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Morrison et al; 2006, Hayashi et al; 2007). Puede ser una alternativa al coma barbitúrico. Produce supresión de la actividad paroxística del EEG e induce un coma por BZD. Tiene una alta fijación en tejidos grasos y muestra una lenta eliminación del organismo. Puede llegar a necesitar ventilación mecánica en UCI, si se emplean dosis altas. Esta pauta tiene una alta tasa de respuestas en SE refractarios, con cifras de hasta un 96% libres de crisis y su mayor eficacia global se relaciona con el empleo de dosis altas de perfusión (Morrison et al; 2006) y las peores respuestas globales se dan en los casos con un inicio tardío de la perfusión (Hayashi et al; 2007). Sin embargo, presenta cifras de mortalidad de un 3-19%, dependiendo de la etiología del SE y de la necesidad o no de ventilación mecánica mantenida (Ozdemir et al; 2005)
2. Anestésicos barbitúricos (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Smith; 2011). Representan un grupo de fármacos con efectos anticomiciales demostrados (evidencia clase C) (Appleton et al; 2000). Tienen una farmacocinética poco adecuada, por su alta liposolubilidad y su lenta eliminación del organismo. Se produce un coma barbitúrico que requiere respiración asistida en UCI y monitorización estrecha de tensión arterial. Se debe procurar emplear tan sólo durante 24-48 horas, por su alta tasa de morbi-mortalidad. Hay que controlar sus efectos mediante registros periódicos de EEG, midiendo la periodicidad de los intervalos paroxismo-supresión. Se incluyen en este grupo el tiopental y el pentobarbital. El tiopental presenta una cinética saturable y tiene una vida media prolongada a concentraciones altas. Existe un alto riesgo de hipotensión con este fármaco, por lo cual se recomienda asociar siempre inotrópicos (dopamina). El pentobarbital es un metabolito activo del tiopental. Tiene una vida media más corta, pero con efectos adversos similares.
3. Anestésicos no barbitúricos (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Smith; 2011). En este grupo, existe menos información sobre sus posibles efectos anticomiciales y algunos de estos fármacos pueden producir incluso actividad epileptiforme en el EEG o bien crisis convulsivas. Su farmacocinética, sin embargo, reviste menos problemas en comparación con los anestésicos barbitúricos clásicos. Se reservan para última línea de terapia.
Propofol (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Smith; 2011, Schor et al; 2005, Prasad et al; 2001, Niermejier et al; 2003). Su empleo es controvertido y debe usarse con precaución. Tiene una rápida acción y una rápida recuperación tras su uso i.v. Algunos autores abogan por usar propofol antes que tener que llegar a emplear tiopental o pentobarbital (Schor et al; 2005). Se han publicado respuestas clínico-EEG similares a MDZ en perfusión i.v. continua (Prasad et al; 2001). Sin embargo, otros autores desaconsejan el uso de propofol por una mayor tasa de morbi-mortalidad con este fármaco (Niermejier et al; 2003). Aunque se ha objetivado un efecto anticomicial evidente y la normalización del trazado crítico EEG, también se conoce que puede precipitar crisis convulsivas, probablemente en relación con dosis altas o con supresión brusca y que parece activar, en algunos casos, las descargas epilépticas generalizadas en el EEG (Niermejier et al; 2003, Smith; 2011).
Isoflurano (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Smith; 2011). Sólo está disponible por vía inhalatoria. Tiene también un posible efecto inductor de crisis. Se ha descrito un efecto beneficioso en SE resistentes a todo tipo de fármacos antiepilépticos. Se tienen menos datos sobre el empleo de otros anestésicos por vía inhalatoria como enflurano y halotano. Todos estos agentes pueden aumentar la presión intracraneal, por lo que sólo deben emplearse en SE refractarios a todo tipo de tratamientos y bajo estrecha monitorización en UCI.
Etomidato (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Smith; 2011). Tiene un riesgo elevado de insuficiencia suprarrenal por hemorragia aguda de las glándulas suprarrenales. Puede inducir mioclonías y descargas de polipunta-onda en el EEG. Se han descrito casos con control de crisis tras evolucionar como SE refractarios, pero el número de referencias es aún muy escaso (Abend et al; 2010).
Ketamina (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Smith; 2011, Mewasingh et al; 2003). La ketamina tiene un posible papel en el SE no convulsivo refractario (Mewasingh et al; 2003). Como EA destaca la presencia de un potencial riesgo de depresión respiratoria, apnea y laringoespasmo.
4. Paraldehido (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Rowland et al; 2009). Puede emplearse por vía i.v. y v.r. Un 70% de la dosis se metaboliza en el hígado y un 30 % se elimina por vía pulmonar. Puede producir depresión respiratoria, hipotensión, acidosis metabólica, hemorragia pulmonar y fallo hepato-renal. Aunque es un fármaco que se mantiene en los protocolos de SE de USA, donde se recomienda usar paraldehido por v.r. si falla DZP v.r. y no tenemos disponibilidad de vía i.v. (evidencia clase C) (Appleton et al; 2008), no tenemos experiencia suficiente en nuestro país para recomendar su uso.
5. Clormetiazol (Brown et al; 1991, Tunik et al; 1992, García-García et al; 1988, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008). Es posible su empleo por vía i.v. y v.r. Presenta riesgo de depresión cardio-respiratoria e hipotensión. Estos efectos pueden potenciarse si se asocia con PB i.v. Debido a estos EA potencialmente graves, su empleo está ahora muy limitado y restringido.
6. Lidocaína (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Hattori et al; 2008). Es empleada para uso i.v. exclusivo. Tiene una rápida acción, pero con efectos transitorios, lo cual impide su empleo como fármaco de mantenimiento. Produce pocos efectos sedantes. Presenta un alto riesgo de hipotensión, asistolia y arritmias cardiacas. Además, pueden aparecer convulsiones generalizadas si se superan niveles séricos de 15-20 mcg/ml (Brown et al; 1991).
7. Hidrato de cloral (Brown et al; 1991, Tunik et al; 1992, Abend et al; 2008, Abend et al; 2010, Freilich et al; 2010, Singh et al; 2009, Appleton et al; 2000, Appleton et al; 2008, Hindley et al; 2005, Krsek et al; 2002). Se emplea sólo por enemas por v.r. Tiene riesgo potencial de apneas obstructivas y produce sedación y depresión potencial del SNC. En la actualidad, se ha recuperado su uso clínico para SE en síndromes especiales como el síndrome de Dravet y la epilepsia parcial migratoria maligna del lactante (Hindley et al; 2005, Krsek et al; 2002).
Otros fármacos con potencial empleo en el SE infantil.
1. Otros FAE: se han empleado diversos FAE, con resultados variables, para el tratamiento de los SE refractarios, incluyendo CBZ, TPM, LTG, CLB, y NTZ (Abend et al; 2010, Appleton et al; 2008).
Topiramato (TPM). Se administra por sonda nasogástrica (SNG). Se han descrito casos que responden con TPM en 24 horas a dosis de 5-6 mg/Kg/día (Kahriman et al; 2003). Para otros autores, parece ser útil una pauta de carga de 10 mg/Kg el primer día (Perry et al; 2006).
Lamotrigina (LTG). Aunque no está disponible en el mercado, se ha empleado LTG por vía i.v. en una solución acuosa estable en casos de SE no convulsivo (Walton et al; 1996, Nielsen et al; 2008). No requiere dilución, es bien tolerada globalmente, consigue picos séricos en 30 minutos, se muestra bioequivalente respecto a las dosis orales. Se han usado pautas de hasta 100-300 mg/dosis en casos de SE no convulsivos refractarios.
2. Vitaminas y cofactores: se debe considerar seriamente su empleo en casos de SE refractarios o crisis agudas repetitivas en niños menores de 3 años de edad (Campistol; 2000, Appleton et al; 2008) (ver “vitaminas y cofactores para el SE.jpg”).
Piridoxina (vitamina B6) (Devinsky et al; 2008, Campistol; 2000, Gospe; 2006, Basura et al; 2009, Prasad et al; 2006, Appleton et al; 2008). No se debe olvidar su uso en crisis refractarias en niños menores de 3 años con historia de epilepsia crónica o en SE neonatales establecidos o en SE refractarios en lactantes (evidencia clase C) (Appleton et al; 2008).. Se emplean bolos i.v. de 100-300 mg/dosis (dosis máxima total de 600 mg). Se recomienda realizar monitorización estrecha por el riesgo de hipotensión y reacciones de hipersensibilidad. Si responden, se puede pasar luego a una pauta oral de 10-50 mg/Kg/día.
Piridoxal fosfato (Devinsky et al; 2008, Wang et al; 2005, Pearl et al; 2007). Se debe considerar en todas las crisis refractarias en neonatos y niños menores de 3 años de edad sin etiología definida. Algunos niños que no responden a piridoxina pueden responder a piridoxal fosfato posteriormente. Se recomienda una dosis inicial de 10 mg/Kg i.v. y después una pauta de 2,5 mg/Kg/dosis cada 6 horas durante 3 días. Algunas formas refractarias pueden precisar hasta 40 mg/Kg. Si responden al piridoxal fosfato, se puede continuar luego con dosis orales de 10 mg/kg de piridoxina. Dada su alta eficacia terapéutica, algunos autores propugnan iniciar piridoxal fosfato antes que piridoxina, a pesar de su elevado precio (Wang et al; 2005, Pearl et al; 2007).
Ácido folínico (Devinsky et al; 2008, Campistol; 2000, Nicolai et al; 2006, Frye et al; 2003, Prasad et al; 2006). Se debe considerar en crisis neonatales rebeldes, en crisis refractarias de lactantes, en todo SE en niños menores de 3 años, y en casos que no respondieron o que presentaron sólo respuesta parcial a piridoxina. Se administra a dosis de 5-10 mg cada 12 horas por SNG y es bien tolerado globalmente.
Biotina (Devinsky et al; 2008, Campistol; 2000, Prasad et al; 2006). Se debe considerar en crisis neonatales rebeldes, en crisis refractarias en lactantes y en todo SE en niños menores de 3 años. Se pauta cuando han fallado las vitaminas y cofactores previos. Se administra a dosis de 20 mg por SNG o por vía i.m. Es bien tolerada globalmente.