Deficiencia de sulfito-oxidasa-cofactor-molibdeno
La deficiencia de sulfito oxidasa-cofactor molibdeno es una enfermedad neurometabólica que se caracteriza por un retraso psicomotor severo y una muerte prematura.
La sulfito oxidasa es una de las 3 enzimas en humanos que requiere molibdeno como cofactor, las otras dos enzimas que precisan de molibdeno son la xantina oxidasa y la aldehído oxidasa.
La sulfito oxidasa metaboliza sulfitos potencialmente tóxicos a sulfitos no tóxicos (sulfatos). La xantino deshidrogenasa cataliza la hidroxilación de hipoxantina a xantina y desde ahí a ácido úrico. La aldehído oxidasa está relacionada con la hidroxilación de la hipoxantina a xantina, pero no a ácido úrico.
El déficit de xantino deshidrogenasa (xantinuria) puede producir el depósito de la xantina en riñones y en el músculo, provocando la aparición de cálculos renales y miopatía, o ser completamente asintomática. La deficiencia de aldehído oxidasa no ha sido descrita en humanos (Hanley 2005).
- La enfermedad
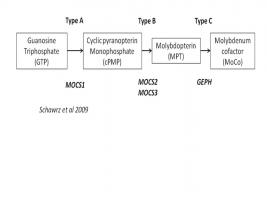
La deficiencia de sulfito oxidasa se produce debido a mutaciones en el gen SUOX que codifica esta enzima y también puede producirse por mutaciones en los diversos genes implicados en la síntesis del cofactor MoCo: MOCS1 (deficiencia tipo A), MOCS2 (deficiencia tipo B), y GEPH. Estas deficiencias son trastornos genéticos de herencia autosómica recesiva (Aukett 1998).
Causa síntomas neurológicos graves, fundamentalmente convulsiones neonatales refractarias, encefalopatía, microcefalia, rasgos dismórficos, litiasis renal y luxación del cristalino (más tardía) (Johnson 2001). Se ha observado una variabilidad en la gravedad y la edad de comienzo. Hasta en un 90% de los casos (Sintha 2010), se inicia en el período neonatal inmediato con dificultades para la alimentación y crisis convulsivas refractarias (Johnson and Duran 2001). También hay casos descritos con comienzo más tardío.
Suelen ser niños con un fenotipo peculiar con cara alargada, mejillas gruesas, hipertelorismo, labios gruesos, filtrum amplio y nariz pequeña (Palacios 2008).
El cofactor del molibdeno es sintetizado en una vía metabólica de varios pasos y son cuatro los genes que se requieren para esta vía (MOCS1, MOCS2, MOCS3 y GEPH). La mayoría de las mutaciones se han encontrado en MOCS1 y MOCS2 (Reiss 2005).
- Hallazgos de laboratorio y en la neuroimagen
En los estudios de laboratorio encontramos hipouricemia marcada, así como concentraciones descendidas o indetectables de homocisteína plasmática total (Sass 2006, Refsum 2004) y niveles aumentados en orina de sulfitos, thiosulfato, S-sulfocisteina, taurina, hipoxantina y xantina.
En la RM cerebral se suelen encontrar de forma habitual quistes subcorticales y atrofia (Serrano et al 2007; Teksam et al 2005). Las alteraciones neurorradiológicas consisten en pérdida progresiva de la sustancia blanca, y pueden mostrar cavidades quísticas que recuerdan a la encefalopatía hipóxico-isquémica perinatal. Otras alteraciones descritas son atrofia cortical y cerebelosa, dilatación ventricular, calcificaciones focales, etc (Salvan 1999).
- Diagnóstico
La detección de sulfitos en orina mediante tira reactiva es una forma rápida y sencilla, pero los sulfitos urinarios son muy inestables, por lo que pueden dar resultados negativos falsos. Los tiosulfatos y la S-sulfocisteína son más estables, pero su determinación no está al alcance de todos los laboratorios.
La hipohomocisteinemia es un hallazgo típico del déficit aislado de sulfito oxidasa y del déficit del cofactor molibdeno, y una herramienta útil propuesta por algunos como la prueba inicial de cribado (Palacios 2008).
Cuando se sospecha esta enfermedad, se debe proceder a realizar estudios enzimáticos y/o genéticos. Debe considerarse el diagnóstico en los casos de crisis rebeldes en el período neonatal, y clínica y radiología sugestivas de encefalopatía hipóxico-isquémica, sin antecedentes perinatales compatibles.
- Diagnóstico prenatal
El diagnóstico genético prenatal es más informativo que el estudio de los metabolitos pero sólo debe ser realizado en familias con mutación conocida (Johnson 2003).
- Tratamiento
Se han hecho múltiples intentos para reducir los sulfitos mediante una intervención dietética, o disminuyendo su absorción, pero ninguna de las intervenciones dietéticas ha resultado excesivamente efectiva. Se propone como terapia una dieta con restricción proteica con dieta restringida en metionina y suplementada en cistina, así como el dextrometorfano (inhibidor del receptor de NMDA para limitar la excitotoxicidad).
Las convulsiones son a menudo resistentes al tratamiento.
Actualmente sólo hay terapia efectiva para el tipo A de la enfermedad (causada por mutaciones del gen MOCS1) (Reiss and Johnson 2003), mediante la administración intravenosa de cPMP (cyclis pyranopterin monophosphate). Esta terapia fue administrada por primera vez por Schwarz 2004, en un bebé homocigoto para la mutación MOCS1B G588R, clasificado como tipo A con defecto en la síntesis de cPMP. En la RM realizada al mes de vida se evidenció atrofia y pérdida de la diferenciación de la sustancia gris y blanca. La terapia sustitutiva intravenosa con cPMP se inició en el día 36 de vida, extrapolando la dosis desde la que había sido efectiva en los ratones. Dado que las infusiones de cPMP fueron bien toleradas sin efectos secundarios, se continúo con infusiones diarias. Después de unos pocos días se apreció la normalización de los valores elevados de S-sulfocisteina y tiosulfato y mejor contacto visual del bebé. A los 18 meses quedó libre de crisis, pero las lesiones cerebrales instauradas antes de iniciar el tratamiento no se corrigieron.
Bibliografía
Aukett A, Bennett MJ, Hosking GP. Molybdenum cofactor deficiency: an easily missed inborn error of metabolism. Dev Med Child Neurol. 1998;30:531-5.
Catherine A. Hanley, P. Ellen Grant, Kalpathy S. Krishnamoorthy and Vivian E. Shih Wen-Hann Tan, Florian S. Eichler, Sadaf Hoda, Melissa S. Lee, Hagit Baris. Isolated Sulfite Oxidase Deficiency: A Case Report With a Novel Mutation and Review of literature. Pediatrics 2005;116;757
Johnson JL, Duran M. Molybdenum cofactor deficiency and isolated sulfite oxidase deficiency. En: Scriver CR, Sly WS, Childs B, Beaudet AL, Valle D, Kinzler KW, et al, editores. The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill Professional; 2001. p. 3163-7.
Palacios Cuesta A, García Silva M.T., Sánchez del Pozo J., Nogales Espert A., Puche Mira A y Ugarte Pérez M. An Pediatr (Barc). 2008;69(2):181-96
Refsum H, Grindflek AW, Ueland PM, Fredriksen A, Meyer K, Ulvik A, et al. Screening for serum total homocysteine in newborn children. Clin Chem.2004;50:1769-84.
Reiss J, Johnson JL (2003) Mutations in the molybdenum cofactor biosynthetic genes MOCS1, MOCS2, and GEPH. Hum Mutat 21:569–576
Reiss J, Bonin M, Schwegler H et al. (2005) The pathogenesis of molybdenum cofactor deficiency, its delay by maternal clearance, and its expression pattern in microarray analysis. Mol Genet Metab 85:12–20
Salvan AM, Chabrol B, Lamoureux S, Confort-Gouny S, Cozzone PJ, Vion-Dury J. In vivo brain proton MR spectroscopy in a case of molybdenum cofactor deficiency. Pediatr Radiol. 1999;29:846-8.
Sass JO. Laboratory diagnosis of sulphite oxidase deficiency. Eur J Pediatrics 2006; 165:739
Schwarz G, Santamaria-Araujo JA, Wolf S, Lee HJ, Adham IM, Grone HJ, Schwegler H, Sass JO, Otte T, Hanzelmann P, Mendel RR, Engel W, Reiss J.2004. Rescue of lethal molybdenum cofactor deficiency by a biosynthetic precursor from Escherichia coli. Hum Mol Genet 13:1249–1255
Serrano M, Lizarraga I, Reiss J et al. (2007) Cranial ultrasound and chronological changes in molybdenum cofactor deficiency. Pediatr Radiol 37:1043–1046
Sintha D. Sie & Rogier C. J. de Jonge & Henk J. Blom & Margot F. Mulder & Jochen Reiss & R. J. Vermeulen & Cacha M. P. C. D. Peeters-Scholte. Chronological changes of the amplitude-integrated EEG in a neonate with molybdenum cofactor deficiency. J Inherit Metab Dis, 2010.
Teksam O, Yurdakok M, Coskun T (2005) Molybdenum cofactor deficiency presenting with severe metabolic acidosis and intracranial hemorrhage. J Child Neurol 20:155–157
Unidad de seguimiento de la PKU y otros trastornos metabólicos. Hospital Sant Joan de Déu