Tratamiento de la epilepsia en la Infancia
INICIO DEL TRATAMIENTO ANTIEPILEPTICO.
Ante un niño con una primera CE (crisis epiléptica) o epilepsia de inicio reciente (dos o más CE) los riesgos y beneficios de iniciar el tratamiento deben discutirse con los padres para tomar una decisión consensuada. Los aspectos básicos a tener en cuenta son los siguientes:
- Grado de seguridad en el diagnóstico: las dudas en el diagnóstico de CE son frecuentes y a menudo se cometen errores (Stroink et al 1998). Por tanto no debe iniciarse un tratamiento antiepiléptico sin tener una razonable certeza del diagnóstico.
- Capacidad del tratamiento para alterar la historia natural de la enfermedad: en la actualidad hay evidencias suficientes como para asegurar que la demora en el inicio del tratamiento hasta la segunda CE o incluso hasta que han ocurrido varias crisis si el diagnóstico no es seguro, no implicará un peor pronóstico para el paciente (Leone et al 2006, Marson et al 2005).
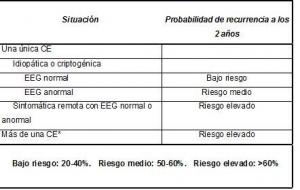
- Riesgo de recurrencia de las CE: el riesgo de recurrencia de una primera CE no tratada en niños es del 40-60% a los dos años (Berg et al 1991, Marson et al 2005, Shinnar et al 1996, Stroink et al 1998, Ramos Lizana et al 2000). Tras dos o más CE el riesgo es más elevado, al menos del 60% a los dos años (Marson et al 2005, Hauser et al 1998, Shinnar et al 2000). La etiología sintomática remota y un EEG anormal aumentan el riesgo de recurrencia (Stroink et al 1998, Shinnar et al 1996, Ramos Lizana et al 2000, Kim et al 2006). En niños, el riesgo de recurrencia tras una primera CE sintomática remota es del 52-96% a los dos años en comparación con el 33%-50% tras una primera CE idiopática o criptogénica (Shinnar et al 1996, Stroink et al 1998, Ramos Lizana et al 2000 y 2009). En niños, un EEG anormal únicamente aumenta el riesgo de recurrencia en los casos con crisis idiopáticas o criptogénicas. El riesgo de recurrencia en los pacientes con crisis idiopáticas o criptogénicas y alteraciones epileptiformes en el EEG es del 52-65% a los dos años en comparación con el 24-42% para aquellos con un EEG normal (Shinnar et al 1996, Ramos Lizana et al 2000).
En la tabla 1 se muestra un esquema simplificado para informar a los padres sobre el riesgo de recurrencia en diversas situaciones. Como se ha explicado, el riesgo es elevado en los niños con una primera CE sintomática remota y en aquellos con más de una CE, situaciones en las cuales puede considerarse el inicio del tratamiento antiepiléptico.
- Crisis múltiples: las crisis múltiples (más de una en 24 horas) no aumentan el riesgo de recurrencia (Shinnar et al 1996, Ramos Lizana et al 2000, Kho et al 2006).
- Riesgos derivados de la recurrencia de las crisis: son en general pequeños. Incluyen problemas sociales y psicológicos, riesgo de lesión física durante la crisis y riesgo de recurrencia en forma de estado epiléptico y sus consecuencias (Shinnar et al 1996, Van der Broeck et al2004, Jacoby 2007).
- Con respecto al estado epiléptico, la presentación de la primera CE como estado epiléptico aumenta el riesgo de recurrencia únicamente cuando las crisis son sintomáticas remotas (Hauser et al 1990, Shinnar et al 1996). Por otra parte, el riesgo de que un niño con una primera CE en forma de estado epiléptico sufra un nuevo episodio de estado epiléptico es del 20-30%. Está claro que los pacientes con crisis sintomáticas remotas afrontan esa tasa de riesgo, pero probablemente el riesgo de recurrencia como estado epiléptico es pequeño en aquellos con crisis no sintomáticas (Shinnar et al 1992, Berg et al 2004, Stroink et al 2007). Por lo tanto, las evidencias disponibles sugieren que no es necesario iniciar un tratamiento antiepiléptico tras una primera CE en forma de estado epiléptico, salvo que la etiología sea sintomática.
- Eficacia de la medicación para prevenir las recurrencias: el tratamiento con fármacos antiepilépticos no garantiza la supresión total de las CE. En los pacientes tratados tras una primera CE persiste un riesgo de recurrencia del 25%-32%. En los pacientes sin factores de riesgo de recurrencia (crisis “no sintomáticas” y EEG normal) el tratamiento tiene una escasa eficacia (First Seizure Trial Group 1993, Marson et al 2005).
- Efectos adversos de la medicación: efectos adversos lo suficientemente graves como para precisar la retirada de la medicación ocurren en un 5% de los casos y como mínimo otro 5% tienen efectos adversos tolerables. En la infancia son especialmente preocupantes los efectos cognitivos y sobre el comportamiento.
- Síndrome epiléptico: en los niños con epilepsia benigna de la infancia con puntas centrotemporales y crisis bien toleradas puede evitarse el tratamiento. Por extensión, algunos autores aconsejan la abstención terapéutica en la epilepsia occipital benigna nocturna tipo Panayiotopoulos, pero todavía no existen estudios que avalen esta práctica.
- Frecuencia de las CE: en los casos con CE muy espaciadas en el tiempo (más de un año) es razonable no iniciar el tratamiento.
ELECCIÓN DEL FAE
- Con los datos disponibles en la actualidad, la elección del FAE a emplear se basa principalmente en el tipo de CE. Hay pocos estudios sobre la eficacia de los FAEs en los diferentes síndromes epilépticos.
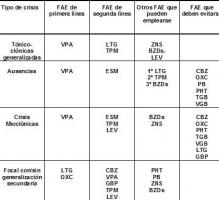
- En las crisis y epilepsias generalizadas los fármacos más recomendados por las diferentes guías clínicas y revisiones sistemáticas son el VPA y la LTG (Guía NICE 2004, Guía SIGN 2005, Guía SADE 2009, Glauser et al 2006). Recientemente un gran ensayo clínico aleatorizado sin cegamiento para comparar la eficacia y tolerabilidad del VPA, la LTG y el TPM (Marson et al 2007) concluyó que el VPA es el fármaco de elección para el tratamiento inicial en monoterapia de las crisis generalizadas o inclasificables (cuando no se puede asegurar con certeza si se trata de crisis generalizadas o focales). Por tanto puede recomendarse el VPA como fármaco de elección. En mujeres en edad fértil se prefiere la LTG por su menor potencial teratogénico. Algunos FAE pueden agravar las crisis de ausencias y mioclónicas y por tanto no deben utilizarse (tabla 2).
- En las crisis y epilepsias focales los fármacos más recomendados por las diferentes guías clínicas y revisiones sistemáticas son el VPA, la CBZ, la OXC y la LTG (Guía NICE 2004, Guía SIGN 2005, Guía SADE 2009, Glauser et al 2006). Más recientemente un gran ensayo clínico aleatorizado sin cegamiento para comparar la eficacia y tolerabilidad de la CBZ, la GBP, la LTG, la OXC y el TPM para el tratamiento de las crisis focales concluyó que la LTG es el tratamiento de elección, si bien la diferencia con la OXC no fue estadísticamente significativa y el VPA no fue incluido entre los fármacos a estudio (Marson et al 2007b). En consecuencia, pueden recomendarse la LTG y la OXC como fármacos de primera línea.
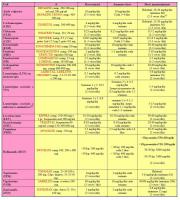
- La tabla 2 muestra información más detallada para la elección del tratamiento, la tabla 3 los efectos secundarios más frecuentes de los fármacos y la tabla 4 su dosificación.
- Los fármacos antiepilépticos se toman con las principales comidas (desayuno, comida y cena). No es necesaria su administración estricta cada 8 o 12 horas. Si se olvida alguna dosis, ésta debe tomarse en cuanto se recuerde o añadirla a la dosis siguiente. Si el niño vomita antes de 30 minutos de la ingestión del fármaco es probable que lo haya expulsado con el vómito y se aconseja repetir la dosis.
CONTROLES Y CURSO DEL TRATAMIENTO
Cambios o adición de FAEs
- En un 5% de los casos es preciso suspender el FAE por efectos adversos intolerables.
- Si con el primer FAE bien tolerado no se consigue el control de las crisis a las dosis habituales, debe aumentarse progresivamente la dosis de este FAE hasta la dosis máxima recomendada o tolerada (Guía SADE 2009). Un 60% de las epilepsias se controlan con el primer FAE.
- Si no se consigue el control con el primer FAE a la dosis máxima puede optarse por una de las dos siguientes actitudes (no se ha demostrado cuál es mejor) (Guía SADE 2009):
- Retirada progresiva del primer FAE con introducción de un segundo FAE en monoterapia.
- Asociar un segundo FAE en politerapia. Si la combinación resulta eficaz debe hacerse un intento de retirada del primer FAE para comprobar si lo que ha sido eficaz es la asociación o el segundo FAE.
- Con el segundo régimen terapéutico en mono o politerapia se consigue el control en el 30% de las epilepsias.
- Si el segundo FAE fracasa se utilizarán secuencialmente otros FAEs, intentando no emplear simultáneamente más de dos FAE o a lo sumo tres. Cuando se emplean FAEs en politerapia es aconsejable evitar en lo posible dosis elevadas de cada uno de ellos. Hay pocos estudios sobre la eficacia y tolerabilidad de las asociaciones de FAEs, por lo que las recomendaciones se basan principalmente en consideraciones teóricas. Se consideran asociaciones beneficiosas VPA+ESM y VPA+LTG (aumentan los niveles de LTG y es necesario emplear dosis más bajas de ésta), supuestamente beneficiosas CBZ/OXC + VPA (disminuyen los niveles de VPA y aumentan los de CBZ), CBZ/OXC + LEV y LTG/VPA + LEV, TPM, ZNS y supuestamente perjudiciales PB/PRM + CZP/CLB, PB/PRM + LTG/TGB/TPM, CBZ + PHT, CBZ/OXC/PHT + LTG (Guía SADE 2009). En los pacientes en que han fracasado dos regímenes terapéuticos todavía se consigue el control con los sucesivos regímenes terapéuticos en un 20% de los casos (Ramos Lizana et al 2009).
Exploraciones complementarias
- Si el primer EEG ha sido normal se realizará un EEG de sueño (o al menos con deprivación de sueño). Si éste también es normal se solicitarán nuevos registros estándar hasta un total de cuatro (después de un cuarto EEG es poco frecuente encontrar alteraciones). Si persisten las dudas diagnósticas puede recurrirse al registro prolongado video-EEG (Guía SADE 2009).
- No tiene sentido solicitar EEGs de control con la excepción de los espasmos infantiles y la epilepsia ausencia (Guía SADE 2009, Guía NICE 2004).
- No es necesaria la determinación rutinaria de niveles de FAE ni para ajustar la dosis inicial ni para monitorizar el tratamiento, ya que las evidencias disponibles sugieren que esta práctica no mejora el control de las CE ni la incidencia de efectos adversos. La determinación de niveles puede ser útil en caso de sospecha de incumplimiento terapéutico, sospecha de toxicidad y manejo de las interacciones farmacológicas (Guía SADE 2009, Guía NICE 2004).
- Tampoco están indicadas otras determinaciones analíticas rutinarias (Guía SADE 2009, Guía NICE 2004).
Consejos sobre el estilo de vida
- Los niños con CE deben llevar una vida normal, evitando la sobreprotección o el estigmatizarlos como enfermos.
- Es preferible que se duchen en lugar de bañarse si lo hacen solos.
- Evitarán nadar sin supervisión y montar en bicicleta por vías transitadas o sin acompañamiento.
- Los adolescentes con epilepsia generalizada idiopática evitarán el consumo de alcohol y la falta de sueño.
- Excepto en los raros casos en que se haya demostrado fotosensibilidad no hay limitaciones en el empleo de videojuegos.
SUPRESION DEL TRATAMIENTO ANTIEPILEPTICO
La decisión de suspender la medicación debe consensuarse entre el médico y la familia del niño teniendo en cuenta los siguientes aspectos:
- Capacidad de la supresión para alterar el curso natural de la enfermedad:
La supresión de la medicación antiepiléptica no modifica el pronóstico a largo plazo de la epilepsia (Chadwick et al 1996).
- Riesgo de recurrencia tras la retirada de la medicación:
En niños libres de crisis durante dos o más años el riesgo es del 20-30% a los dos años (Shinnar et al 1994, Ramos Lizana et al 2010). Al valorar este riesgo es importante tener en cuenta que la continuación del tratamiento antiepiléptico no garantiza la ausencia de recurrencias.
- Factores pronósticos del riesgo de recurrencia:
En adultos se dispone de un sistema de puntuación para valorar el riesgo de recurrencia tras la retirada de la medicación o la continuación del tratamiento en pacientes libres de crisis durante dos o más años en función de varios factores pronósticos (MRC 1991 y 1993). No obstante, los factores pronósticos encontrados en este estudio son diferentes de los encontrados en estudios con niños, por lo que no recomendamos su empleo.
En niños el principal factor pronóstico es la etiología de las crisis (Berg et al 1994, Shinnar et al 1994, Ramos Lizana et al 2008). El riesgo de recurrencia es del 17-26% en las crisis idiopáticas/criptogénicas y del 41-42% en las crisis sintomáticas remotas (Shinnar 94, Ramos Lizana et al 2010). Otros posibles factores de riesgo, cuya relevancia no ha sido definitivamente establecida, son el inicio de la epilepsia en la adolescencia y un EEG anormal. En particular, la asociación entre una EEG anormal y un mayor riesgo de recurrencia en diferentes estudios es inconstante y en varios de los que encuentran una asociación significativa, ésta es de escasa relevancia clínica. Además, no se dispone de estimaciones aceptables del riesgo de recurrencia en función de la etiología combinada con estos otros factores de riesgo. En consecuencia, ni la etiología sintomática, ni la edad, ni un EEG anormal son en sí mismas contraindicaciones para suspender el tratamiento (Guía SADE 2009).
¿CUÁNDO DEBE SUSPENDERSE EL TRATAMIENTO?
Se ha demostrado que el riesgo de recurrencia es mayor cuando el periodo libre de crisis antes de suspender la medicación es menor de dos años que cuando es superior a este tiempo (Sirven et al 2003).
En pacientes libres de crisis durante más de dos años, algunos estudios sugieren que el riesgo de recurrencia es tanto menor cuanto mayor es el periodo libre de crisis antes de suspender la medicación, pero no hay pruebas concluyentes al respecto (Tennison et al 1994, MRC 1991 y 1993).
Por lo tanto, es razonable proponer un intento de supresión de la medicación a todos los pacientes que llevan dos años libres de crisis.
¿EN CUÁNTO TIEMPO DEBE SUSPENDERSE LA MEDICACIÓN?
Se desconoce la duración óptima del periodo de supresión de la medicación. Algunos estudios sugieren un riesgo de recurrencia ligeramente más elevado cuando se emplean retiradas más rápidas pero esto no se ha demostrado de modo concluyente (Tennison et al 1994, Ramos Lizana et al 2010).
Son razonables periodos de retirada de entre 4 semanas y 6 meses (MRC 1991 y 1993, Shinnar et al 1994, Ramos Lizana et al 2010).
EPILEPSIA RESISTENTE A FARMACOS, REFRACTARIA O INTRATABLE.
No hay acuerdo unánime en los criterios que debe cumplir una epilepsia para considerarla resistente a fármacos. Según se incluyan pacientes más o menos graves su incidencia oscila entre un 6% y un 23% (Ramos Lizana et al 2009b).
La ILAE la define como el fracaso de dos regímenes terapéuticos bien tolerados y apropiadamente escogidos y utilizados, ya sea en mono o politerapia (Kwan et al 2010).
Se aconseja una valoración más detenida de estos casos con objeto de confirmar el diagnóstico de epilepsia, descartar las pseudocrisis, asegurar que el tratamiento es el correcto para el tipo de epilepsia y valorar la posibilidad de tratamientos alternativos al farmacológico.
Debe tenerse en cuenta que si se adopta una definición como la propuesta por la ILAE, en torno a un 20% de los pacientes que cumplen criterios de refractariedad entrarán posteriormente en remisión con sucesivos regímenes terapéuticos (Ramos Lizana et al 2009b, Berg et al 2009)
OTRAS FORMAS DE TRATAMIENTO (Guía SADE 2009).
Generalmente se plantean en los niños con epilepsia resistente a fármacos.
ESTIMULACIÓN DEL NERVIO VAGO
Consiste en la estimulación intermitente del nervio vago mediante un generador de impulsos eléctricos que se coloca bajo la piel. Las características del estímulo se pueden modificar externamente. Puede ser eficaz en cualquier tipo de epilepsia. Consigue una reducción significativa del número de crisis en un tercio de los pacientes y un porcentaje de pacientes libres de crisis del 5%. Con frecuencia se observa además una mejoría del estado de alerta. Los efectos beneficiosos pueden tardar en aparecer 6-12 meses e incluso más tiempo. Los efectos adversos son poco frecuentes y suelen ser transitorios: complicaciones perioperatorias, apnea del sueño, ronquera, tos irritativa, tortícollis y dolor en el cuello.
DIETA CETOGÉNICA
Dieta con un contenido elevado de grasas y bajo de hidratos de carbono y proteínas. Resulta difícil de seguir para los niños y sus familiares. Hay varios tipos sin que se haya demostrado la superioridad de ninguno de ellos. Puede ser eficaz en cualquier tipo de epilepsia. Debe mantenerse durante tres meses para comprobar si es eficaz. Entre un 7 y un 25% de los pacientes quedan libres de crisis. Efectos adversos: hiperuricemia, hipocalcemia, hipomagnesemia, anorexia, estreñimiento, diarrea, vómitos, irritabilidad, somnolencia, litiasis renal, dislipemia, disminución de peso y talla, osteopenia y mayor riesgo de fracturas, propensión a pequeños sangrados, miocardiopatía, hepatitis, pancreatitis. Cuando es eficaz debe mantenerse durante 2 años y luego retirarla de forma gradual.
CORTICOIDES Y ACTH
Sólo se ha demostrado claramente su eficacia en los espasmos infantiles. Se emplean frecuentemente en el síndrome de Landau-Kleffner y en la epilepsia con punta-onda continua durante el sueño lento. La experiencia clínica y series de casos sugieren que puede ser eficaz en otras situaciones en un pequeño porcentaje de casos. Las dosis y pautas empleadas son muy variables.
RADIOCIRUGÍA
Puede emplearse en cavernomas con alto riesgo de secuelas con el tratamiento quirúrgico, esclerosis temporal medial con contraindicaciones para la cirugía y en los hamartomas hipotalámicos.
CIRUGÍA DE LA EPILEPSIA
1.- Evaluación prequirúrgica:
El objetivo es identificar con precisión la zona epileptógena y determinar que su extirpación no dañará zonas elocuentes (con funciones importantes como el área motora, sensitiva primaria y del lenguaje). Los mejores resultados se obtienen en la epilepsia del lóbulo temporal medial, en las epilepsias neocorticales con lesión única circunscrita y en los síndromes epilépticos hemisféricos. No hay acuerdo en las pruebas que deben efectuarse, cada unidad tiene su propio protocolo. Las más empleadas son las siguientes:
1.1.- Estudio neuropsicológico: se emplea para detectar déficits asociados.
1.2.- Monitorización video-EEG: es útil para confirmar el diagnóstico de epilepsia, descartar que se trate de pseudocrisis o que haya pseudocrisis coexistentes, caracterizar mejor el tipo de CE y síndrome electroclínico y localizar el foco epiléptico.
1.3.- Magnetoencefalografía: registra la actividad funcional cerebral mediante la captación de campos magnéticos. Es útil para localizar el foco epiléptico y delimitar áreas elocuentes. Su coste es elevado. Ofrece información complementaria al EEG.
1.4.- RMN estructural de alta resolución con protocolo específico de epilepsia.
1.5.-Técnicas de neuroimagen funcional:
- PET interictal: muestra un área de hipometabolismo sobre el foco epiléptico. Pueden fundirse las imágenes obtenidas con las de la RMN (PET-RM) para mejorar su sensibilidad.
- SPECT ictal: muestra un área de hiperperfusión en el foco epiléptico. Puede corregistrarse con una RMN (SISCOM: Substraction Ictal SPECT Coregistered to MRI) para mejorar su sensibilidad y especificidad.
- RMN funcional: se basa en que cuando una región cerebral se activa para realizar una tarea se produce un aumento de perfusión en esa zona que puede ser medida mediante el efecto BOLD (Blood Oxigen Level Dependent). Es útil para la localización de áreas elocuentes y de la zona epileptógena (si se registra simultáneamente el EEG).
1.6.- Video-EEG con electrodos semiinvasivos (foramen oval) o invasivos (subdurales o profundos). Está indicada cuando el estudio con electrodos de superficie es discordante o no informativo, cuando se observa una lesión en la RMN que no es concordante con los hallazgos del EEG de superficie y cuando es necesario realizar un mapeo cortical para evitar dañar zonas elocuentes.
Las pruebas básicas para una evaluación prequirúrgica son una evaluación neuropsicológica, una monitorización video-EEG con electrodos de superficie y una RMN de alta resolución con protocolo de epilepsia. Esto suele ser suficiente en la mayoría de las epilepsias temporales mediales y en las epilepsias neocorticales con lesión bien circunscrita. En los casos de epilepsia temporal medial en los que existan dudas sobre la bilateralidad crítica o exista una lesión neocortical asociada puede ser necesario un video-EEG con electrodos invasivos o semiinvasivos y a veces un test de lateralización de la memoria y el lenguaje (test de Wada o RMN funcional). En las malformaciones del desarrollo cortical puede ser necesaria la implantación de electrodos intracraneales para determinar con exactitud la zona epileptógena y cuando ésta se localiza en áreas elocuentes es necesaria la realización de mapeo cortical. Cuando la RMN estructural no muestra ninguna lesión o los resultados de las exploraciones previas no son congruentes puede emplearse alguna técnica de neuroimagen funcional. Estas técnicas permiten en muchos casos la localización del foco epiléptico pero no delimitan de forma precisa su extensión. Por esto son de gran ayuda para planificar estudios de EEG invasivo pero no para guiar los límites de la resección quirúrgica.
2.- Técnicas quirúrgicas:
2.1.- Técnicas de resección: pretenden eliminar la zona epileptógena sin producir ninguna alteración funcional inaceptable.
- Lobectomía temporal anterior con amgidalo-hipocampectomía y amigdalo-hipocampectomía selectiva: se emplea en la epilepsia del lóbulo temporal. Consigue un 60-75% de pacientes sin crisis. Efectos adversos: afectación del campo visual, déficit de memoria visual o verbal, disnomia si se ha intervenido sobre el hemisferio dominante.
- Lesionectomía: resección de la lesión estructural que causa la epilepsia. Se emplea en tumores, cavernomas o malformaciones del desarrollo cortical, incluyendo displasias corticales. Consigue un 60-90% de pacientes sin crisis. Efectos adversos: déficit neurológico focal.
- Resección cortical: en caso de lesión extensa mal circunscrita (de origen traumático, isquémico, postquirúrgico o malformaciones del desarrollo cortical extensas) o epilepsia focal no lesional (sin lesión detectable). Consigue un 25-40% de pacientes sin crisis. Efectos adversos: déficit neurológico focal.
- Hemisferectomía funcional y sus variantes: se emplea en el síndrome de Sturge-Weber, hemimegalencefalia, encefalitis de Rasmussen, síndrome HHE u otras lesiones hemisféricas extensas. En la evaluación prequirúrgica suelen ser suficientes las pruebas básicas. Consigue un 60-80% de pacientes sin crisis. Efectos adversos: aumento del déficit neurológico previo, hidrocefalia.
2.2.- Técnicas de desconexión: se emplea en pacientes con varios focos epilépticos o cuando el foco está ubicado en una zona que no puede ser resecada.
- Transecciones subpiales múltiples: es una alternativa a la resección cortical cuando el foco está en una zona que no puede ser resecada. En la evaluación prequirúrgica suelen ser necesarios los electrodos intracraneales y el mapeo cortical. Resultados: 16% de pacientes sin crisis, 60-70% con reducción importante del número de crisis. Efectos adversos: déficit neurológico focal.
- Sección del cuerpo calloso (total o parcial). Disminuye el número de crisis astáticas. En la evaluación prequirúrgica suelen ser suficientes las pruebas básicas. Efectos adversos: mutismo postquirúrgico transitorio, desconexión interhemisférica cuando la sección es total.
BIBLIOGRAFÍA
- Berg At, Levy SR, Testa FM, D´Souza R. Remission of Epilepsy after Two Drug Failures in Chidren: A Prospective Study. Annals of Neurology 2009; 65:510-519.
- Berg AT, Shinnar S, Testa FM, Levy SR, Frobish D, Smith SN, Beckerman B. Status eilepticus after the initial diagnosis of epilepsy in children. Neurology 2004;63:1027-1034.
- Berg AT, Shinnar S: Relapse following discontinuation of antiepileptic drugs: a meta-analysis. Neurology 1994; 44: 601-608.
- Berg AT, Shinnar S: The risk of seizure recurrence follow¬ing a first unprovoked seizure: a quantitative review. Neurol¬ogy 1991; 41: 965-972.
- First Seizure Trial Group. Randomized clinical trial on the efficacy of antiepileptic drugs in reducing the risk of relapse after a first unprovoked tonic-clonic seizure. Neurology 1993; 43: 478-483.
- Glauser T, Ben-Menachem E, Bourgeois B, et al. ILAE treatment guidelines: evidence-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Epilepsia 2006; 47:1094–120.
- Hauser WA, Rich SS, Annegers JF, Anderson VE: Seizure recurrence after a first unprovoked seizure: an extended fol¬low-up. Neurology 1990; 40: 1163-1170.
- Hauser WA, Rich SS, Lee JRJ, Annegers JF, Anderson VE. Risk of recurrent seizures after two unprovoked seizures. N Eng J Med 1998;338:429-434.
- Jacoby A, Gamble C, Doughty J, Marson A, Chadwick D. Quality of Life outcomes of immediate or delatyed treatment of early epilepsy and single seizures. Neurology 2007; 68:1188-1196.
- Kho LK, Lawn ND, Dunne JW, Linto J. First seizure presentation: Do multiple seizures within 24 hours predict recurrence?. Neurology 2006;67:1047-1049.
- Kim LG, Johnson TL, Marson AG, Chadwick DW; MRC MESS Study group: Prediction of risk of seizure recurrence after a single seizure and early epilepsy: further results from the MESS trial. Lancet Neurol. 2006;5:317-22.
- Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Hauser WA, Mathern G, Moshé SL, Perucca E, Wiebe S, French J. Definition of drug resistant epilepsy: Consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia 2010;51:1069-77.
- Leone MA, Solari A, Beghi E. Treatment of the first tonic-clonic seizure does not affect long-term remission of epilepsy. Neurology 2006; 67:2227-2229.
- Marson A, Jacoby A, Johnson A, Kim L, Gamble C, Chadwick D: Immediate versus deferred antiepileptic drug treatment for early epilepsy and single seizures: a randomised controlled trial. Lancet 2005; 365: 2007-13.
- Marson AG, Al Kharusi AM, Alwaidh M et al: The SANAD study of effectiveness of carbamazepine, gabapentin, lamotrigine, oxcarbazepine, or topiramate for treatment of partial epilepsy: an unblinded randomised controlled trial. Lancet 2007; 369: 1000-1015.
- Marson AG, Al Kharusi AM, Alwaidh M et al: The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalised and unclassifiable epilepsy: an unblinded randomised controlled trial. Lancet 2007; 369: 1016-1026.
- Marson AG, Al-Kharusi AM, Alwaidh M, et al, on behalf of the SANAD Study Group. The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for treatment of generalised and unclassifiable epilepsy: an unblinded randomised controlled trial. Lancet 2007; 369: 1016–26.
- Marson AG, Al-Kharusi AM, Alwaidh M, et al; SANAD Study group. The SANAD study of effectiveness of carbamazepine, gabapentin, lamotrigine, oxcarbazepine, or topiramate for treatment of partial epilepsy: an unblinded randomised controlled trial. Lancet 2007; 369: 1000-15.
- Medical Research Council Antiepileptic Drug Withdrawal Study Group: Randomized study of antiepileptic drug withdrawal in patients in remission. Lancet 1991; 337: 1175-1180.
- Medical Research Council Antiepileptic Drug Withdrawal Study Group: Prognostic index for recurrence of seizures after remission of epilepsy. BMJ 1993; 306: 1374-8.
- National Institute for Clinical Excelence (NICE). The diagnosis and management of the epilepsies in adults and children in primary and secondary care. 2004 (disponible en la página web del NICE).
- Ramos Lizana J, Cassinello García E, Carrasco Marina LL, Vázquez López M, Martín González M, Muñoz Hoyos A: Seizure recurrence after a first unprovoked seizure in childhood: a prospective study. Epilepsia 2000; 41: 1005-1013.
- Ramos Lizana, Aguilera López P, Aguirre Rodriguez J, Casinello García E: response to sequential treatment schedules in childhood epilepsy: risk for development of refractory epilepsy. Seizure 2009;18:620-4.
- Ramos-Lizana J, Aguirre-Rodríguez J, Aguilera-López P, Cassinello-García E: Recurrence Risk after a First Remote Symptomatic Unprovoked Seizure in Childhood: a Prospective Study. Dev Med Child Neurol 2009;51:68-73.
- Recurrence risk after withdrawal of antiepileptic drugs in children with epilepsy: a prospective study. Eur J Paediatr Neurol 2010; 51:68-73.
- Scottish Intercollegiate Guidelines Network. Diagnosis and management of epilepsies in children and young people. March 2005. (Disponible en la página web de este organismo).
- Shinnar S, Berg A, Moshe S: Discontinuing antiepileptic medication in children with epilepsy: a prospective study. Ann Neurol 1994; 35: 534-545.
- Shinnar S, Berg AT, Moshe SL, O`Dell C, Alemany M, Newstein D, Kang H, Goldensohn ES, Hauser A: The risk of seizure recurrence after a first unprovoked afebrile seizure in childhood: an extended follow-up. Pediatrics 1996; 98: 216-225.
- Shinnar S, Berg AT, O´Dell C, Newstein D, Moshe SL, Hauser WA. Predictors of multiple seizures in a cohort of children prospectively followed from the time of their first unprovoked seizure. Ann Neurol 2000;48:140-147.
- Shinnar S, Maytal J, Krasnoff L, Moshe S: Recurrent status epilepticus in children. Ann Neurol 1992; 31:598-604.
- Sirven JL, Sperling M, Wingerchuk DM: Early versus late antiepileptic drug withdrawal for people with epilepsy in remission (Cochrane Methodology Review). In: The Cochrane Library, Issue 4, 2003. Chichester, UK: Jon Wiley & Sons, Ltd.
- Sociedad Andaluza de Epilepsia. Guía Andaluza de Epilepsia 2009. Disponible en la página Web de guía salud.
http://www.guiasalud.es/GPC/GPC_346_Andaluza_Epilepsia.pdf
- Stroink H, Brouwer OF, Arts WA, Geerts AT, Peters AC, van Donselaar CA: The first unprovoked, untreated seizure in childhood: a hospital based study of the accuracy of the diagnosis, rate of recurrence, and long term outcome after recurrence. Dutch study of epilepsy in childhood. J Neurol Neurosurg Psychiatry 1998; 64: 595-600.
- Stroink H, Geerts AT, van Donselaar CA, Peters AC, Brower OF, Peeters EA, Arts WF. Status epilepticus in children with epilepsy: Dutch study of epilepsy in childhood. Epilepsia 2007;48:1708-15.
- Tennison M, Greenwood R, Lewis D, Thorn M: Discontinuing antiepileptic drugs in children with epilepsy: a comparison of a six-week and a nine-month taper period. N Eng J Med 1994; 330: 1407-1410.
- Van den Broek M, Beghi E. Accidents in patients with epilepsy: types, circumstances, and complications: a European cohort study. Epilepsia 2004; 45:667-672.